Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.4 Bogotá Oct./Dec. 2010
1 Hospital General de La Palma, Santa Cruz de Tenerife, España
2 Centro de salud los Llanos de Aridane, Santa Cruz de Tenerife, España
Recibido: 28/04/2010; Aceptado: 25/10/2010
Resumen
Introducción. Los brotes por Sarcoptes scabiei son frecuentes en todo tipo de instituciones sanitarias, iniciándose sobre todo a partir de pacientes con sarna noruega. En forma cada vez más contundente, se recomiendan medidas agresivas y precoces, incluso en casos equívocos.
Materiales y métodos. Este artículo describe un brote en el que se actuó de forma rotunda, pero sólo cuando se había demostrado la transmisión hospitalaria.
Objetivos. Describir y valorar las consecuencias de esta decisión.
Resultados y discusión. Ocurrió un brote pequeño pero, dada la levedad de las consecuencias de la infestación y que se evitó desde un inicio la dispersión de casos por toda la institución, los autores consideran que una demora en la aplicación de medidas agresivas, si permite valorar inequívocamente el riesgo y es de corta duración, favorece un uso más juicioso de los recursos.
Palabras clave. Sarcoptes scabiei, escabiosis.
Abstract
Introduction. Sarcoptes scabiei outbreaks are common in all types of health institutions, starting mostly from patients with Norwegian scabies. Recommendations for action are growing stronger, such as early and aggressive action even in unclear cases.
Materials and methods. This article describes an outbreak where aggressive action was taken, but only when nosocomial transmission was demonstrated.
Objectives. To describe and assess the consequences of this decision.
Results and discussion. A small epidemic occurred, but given the lightness of the infestation consequences and that the spread of cases across the institution was avoided from the beginning, the authors believe that a delay in the implementation of aggressive measures favors a more judicious use of resources, if it allows to assess the risk unambiguously and is short termed.
Key words: Sarcoptes scabiei, scabies, *prevention & control.
Introducción
La escabiosis, o sarna, es una infestación cutánea producida por el ácaro Sarcoptes scabiei que afecta cada año a más de 300 millones de personas y se manifiesta en su forma clásica con prurito intenso y lesiones cutáneas preferentemente interdigitales o en pliegues articulares. Se transmite de persona a persona por medio del contacto directo y, probablemente, también, por medio de fómites, con un periodo de incubación de tres semanas (1).Los brotes hospitalarios son frecuentes en todo el mundo1 y los principales factores asociados a la propagación institucional de la enfermedad son el compromiso inmunitario y la edad avanzada en los pacientes que presentan clínicamente sarna noruega (2).
Para el control de brotes institucionales por escabiosis, los Centers for Disease Control and Prevention (CDC) recomendaban, hasta octubre de 2005 (3), aplicar pautas profilácticas de escabicidas a los contactos sólo en caso de que la transmisión hospitalaria hubiera sido demostrada (4). Actualmente, cuando el caso índice es un paciente con sarna noruega, recomiendan (5,6), al igual que otros autores (7), la actuación rápida, agresiva y mantenida, incluso en circunstancias equívocas.
La aplicación simultánea de tratamiento escabicida profiláctico a todos los contactos, una de las principales medidas de control, es un procedimiento que conlleva un considerable trabajo y esfuerzo organizativo (2), y puede crear una gran alteración del ambiente hospitalario debido a los necesarios cambios de turnos de trabajo y a la alarma social generada por el temor de un gran número de personas de estar infestados.
En ausencia de casos secundarios, puede ser difícil convencer de su necesidad a los administradores de la institución.
El no actuar de forma agresiva y precoz, por otro lado, puede implicar que el brote alcance una magnitud mucho mayor a la esperada, ya que las epidemias por S. scabiei, una vez establecidas, son difíciles de contener (8).
En el brote descrito en este artículo se valoró la profilaxis masiva y precoz de los contactos, pero, debido a que se consideró en aquel momento que la magnitud de la medida excedía con mucho el riesgo percibido (tratar a casi 120 personas sin tener evidencia clara de que la epidemia iba a ocurrir) y a que por aquel entonces (diciembre de 2005) los CDC recomendaban esperar a confirmar la transmisión hospitalaria para actuar, se decidió esperar hasta confirmar el brote. Describir las consecuencias de esa decisión, así como valorarlas, son el objetivo de este artículo.
Fase epidémica latente
Caso índice. El 15 de diciembre de 2005 se diagnosticó sarna noruega en una paciente añosa y con inmunodepresión por una enfermedad crónica grave de base. Se comunicó inmediatamente al Equipo de Control de la Infección, el que instauró las primeras medidas de control, es decir, aislamiento del contacto y el tratamiento del caso índice con escabicidas y ácido salicílico tópicos, e inició la investigación de un posible brote hospitalario por S. scabiei.
Esta mujer, considerada el caso índice, había ingresado ocho días antes con el diagnóstico de toxicodermia. Su estado físico le impedía la autonomía para las actividades de la vida cotidiana, necesitando ayuda para incorporarse en la cama en la que estaba confinada. Desde su ingreso no había sido reubicada ni trasladada fuera de la habitación, y se le habían realizado pruebas radiológicas en la propia habitación mediante dispositivos portátiles, dado su estado de salud.
Definición y búsqueda inicial de casos. Para evaluar la magnitud de la epidemia, se elaboraron las definiciones operativas pertinentes (9) (tabla 1) y se hizo una búsqueda de casos concurrentes (sospechosos o confirmados) entre los pacientes y entre los trabajadores del área hospitalaria en el que estaba hospitalizado el caso índice (planta A1), además de averiguar la existencia de posibles casos anteriores mediante el examen de las historias clínicas de los pacientes hospitalizados durante los dos meses previos.

La búsqueda entre los pacientes se efectuó revisando sus historias clínicas y entrevistando a los médicos responsables; para detectar casos entre los trabajadores, se les hizo una encuesta en la que se inquirieron signos y síntomas sugestivos de la enfermedad para que participaran voluntariamente, recomendándoles que la entregaran personalmente en el servicio de dermatología o contactaran al Equipo de Control de la Infección, para conservar su intimidad. Para el recuento de los pacientes contacto, se contó con la ayuda del Servicio de Admisión Hospitalaria y, para los trabajadores contacto, se consultaron los turnos de trabajo y se entrevistaron personalmente.
Como resultado de las indagaciones, no se identificó ningún caso sospechoso ni confirmado, pero se reconocieron 118 contactos, de los cuales, 67 eran trabajadores y 51 pacientes, 34 de los cuales ya habían sido dados de alta. Quedó sin contabilizar el número de posibles contactos entre los técnicos de radiodiagnóstico y el personal de urgencias, quienes no recordaban si habían estado en contacto con el caso índice o no. El único caso histórico sospechoso identificado fue el del propio caso índice, hospitalizado entre el 14 y el 21 de noviembre, con el diagnóstico de toxicodermia.
El 20 de diciembre, habiendo transcurrido únicamente una semana desde el ingreso del caso índice, se determinó que el brote se hallaba en fase latente, considerando que una proporción de los contactos podría en realidad corresponder a casos en fase de incubación, debido a que el periodo de incubación mínimo de la escabiosis es de 2 a 3 semanas.
Como marco temporal, se estableció como fecha de inicio del brote el 14 de noviembre de 2005, día del primer ingreso del caso índice con cuadro clínico indicativo del diagnóstico de sarna. Como marco geográfico, se establecieron dos zonas: la de riesgo alto, correspondiente al área de hospitalización del caso índice (planta A1), y la de riesgo bajo, correspondiente al resto del hospital, debido a la posibilidad de propagación por parte del personal que realizaba su labor por todas las áreas hospitalarias (extracción de sangre, realización de electrocardiogramas y toma de radiografías portátiles), entre los que había seis trabajadores clasificados como contactos.
Se tomaron medidas adicionales de control, consistentes en ofrecer y dar charlas educativas, y confeccionar y repartir folletos informativos. Como medida de vigilancia se creó un sistema prospectivo de alerta para trabajadores y pacientes consistente en avisar al Equipo de Control de la Infección ante la aparición de cualquier caso sospechoso.
Fase de epidemia establecida
El primer caso secundario pasó desapercibido para el Equipo de Control de la Infección hasta la fase de revisión e informe del brote (figura 1). Se trató de una auxiliar de enfermería en quien se iniciaron los síntomas indicativos la primera semana de diciembre y fue trasladada a otra área hospitalaria (Unidad de Vigilancia Intensiva), antes de que el Equipo de Control de la Infección apareciera en escena.

Entre el 26 y el 28 de diciembre se confirmó la enfermedad en cinco trabajadores, dos celadores y tres auxiliares de enfermería. Todos pertenecían al área de hospitalización del caso índice y habían estado en contacto directo con el mismo. Fueron dados de baja laboral y tratados con permetrina tópica. El periodo total de exposición de uno de ellos fue de tan sólo de treinta minutos.
El 29 de diciembre se decretó que el brote se había establecido y se ejecutó la profilaxis simultánea con permetrina de todos los pacientes y trabajadores clasificados como contactos. No se modificó el marco geográfico.
En un séptimo caso, los síntomas se iniaron la última semana de febrero. Se trató de un celador cuyo lugar de trabajo también era la planta A1, quien había recibido tratamiento profiláctico junto al resto de sus compañeros.
No aparecieron más casos en los meses siguientes.
El Equipo de Control de la Infección recibió información sobre tres pacientes que coincidieron en lugar y fecha de ingreso con el caso índice, y fueron declarados casos confirmados por dermatólogos en el nivel asistencial de la atención primaria (figura 2). Habían sido dados de alta hospitalaria antes del día de la aplicación masiva de la profilaxis, sin haber manifestado signos ni síntomas de la infestación durante su hospitalización.

Resultados
El brote tuvo una duración de 16 semanas desde la detección del caso índice hasta el tratamiento del último caso diagnosticado, con una tasa de ataque global de 8,5%, sin diferencias estadísticas entre las tasas de ataque de los pacientes y las de los trabajadores (p=0,20) (tabla 2).
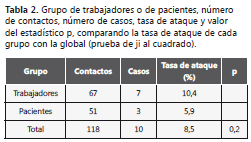
Por categorías profesionales, la tasa de ataque observada en cada uno de los grupos mostró diferencias estadísticamente significativas con la global (p<0,05 para todas las categorías); la máxima correspondió al grupo de los celadores (25,0%) y la siguiente al de los auxiliares de enfermería (21,1%), fueron nulas en el resto de profesionales, a pesar del alto grado de exposición de los Diplomados Universitarios de Enfermería, que representaron más de un tercio del total de trabajadores expuestos (24) (tabla 3).

Hipótesis del mecanismo de contagio
Sólo los celadores y los auxiliares de enfermería se infestaron (tabla 2), de modo que se planteó un mecanismo de transmisión asociado a la movilización de pacientes: el caso índice apoyó sus manos en la zona de flexión del codo del trabajador que le asistió al incorporarse. Al llevar éste manga corta, hizo contacto con la piel del enfermo. Los trabajadores transmitieron luego, de forma similar, la infestación a los demás pacientes en cama: aunque llevaban guantes, los pacientes se apoyaron en las flexuras de sus codos, donde estaban los ácaros. Este mecanismo coincide con la observación que el personal sanitario infestado por S. scabiei no suele presentar lesiones en las manos (10).
Discusión
En las dos ocasiones en las que el paciente con sarna noruega estuvo hospitalizado sin aislamiento produjo casos secundarios, por lo que los autores no se plantean que la aplicación de las medidas de profilaxis masiva podría no haber sido necesaria. La duda es si su aplicación debió haberse adelantado o si se actuó de forma correcta.
Se tardó 14 días en indicar e implementar la profilaxis simultánea de 118 personas, cuando se pudo haber realizado en 5. Las consecuencias fueron la aparición de un brote, con 10 personas afectadas, si se compara con los datos de Vorou et al. (2) que identificó 19 epidemias hospitalarias, iniciadas en su gran mayoría por el ingreso de un paciente con sarna noruega, y quienes presentaron una media de 57 afectados (rango, 9 a 360).
Si se hubiera adelantado profilaxis masiva, probablemente, se hubiera evitado 6 de los 7 casos entre los trabajadores, pues no se habría evitado la infestación del primer caso que ocurrió antes de avisar al Equipo de Control de la Infección. Los casos entre los pacientes se debieron a problemas de comunicación entre los niveles asistenciales, ya que no se hizo la profilaxis entre los contactos que se encontraban por egresar, y no al retraso en la indicación, aunque su adelanto habría permitido captar un mayor número de pacientes que tuvieron el contacto en el hospital: en el momento que se indicó la profilaxis masiva, se había dado de alta a 34 pacientes clasificados como contactos.
No obstante, creemos que la aplicación de la profilaxis masiva fue eficaz y suficientemente precoz como para evitar la aparición de la mayoría de las infestaciones clínicas, considerando las tasas medias de ataque descritas en la literatura.
Respecto a la propagación de la enfermedad por otras áreas hospitalarias, los autores opinan que el riesgo estuvo ligado en todo momento al paciente con sarna noruega de acuerdo con la hipótesis sobre el mecanismo de contagio, en la cual los trabajadores actuaron como vectores más que como fuente de infestación.
Esta hipótesis es epidemiológicamente plausible debido a que la fecha de inicio de los síntomas de los pacientes coincide con su infestación directa a partir del caso índice. Desde este punto de vista, el aislamiento del caso índice fue el factor decisivo para evitar la propagación y el leve retraso en la aplicación de la profilaxis masiva no
aumentó ese peligro. A favor de esta teoría está el hecho de que la auxiliar de enfermería que fue trasladada a la unidad de medicina intensiva estuvo seis meses infestada sin producir contagios en el ámbito hospitalario.
En conclusión, opinamos que el retraso en la aplicación de la medida más aparatosa, la aplicación de tratamiento profiláctico a todos los pacientes y trabajadores hasta confirmar que la epidemia se haya establecido, puede justificarse desde el punto de vista del uso juicioso de los recursos si se han instaurado de forma rápida y eficaz el resto de medidas y el retraso es de corta duración.
Correspondencia: Pablo Jadraque, Hospital General de La Palma, Santa Cruz de Tenerife, C/ Buenavista de Arriba s/n. 38713 Breña Alta. Santa Cruz de Tenerife, España. Fax: (92) 218-5115. Dirección electrónica: pjadjim@gobiernodecanarias.org
Bibliografía
1. Chosidow OO. Scabies and pediculosis. Lancet. 2000;355:819-26. [ Links ]
2. Vorou R, Remoudaki HD, Maltezou. Nosocomial scabies. J Hosp Infect. 2007;65:9-14. [ Links ]
3. Bolyard EA, Tablan OC, Williams WW, Pearson ML, Shapiro CN, Deitchman SD, et al. Guideline for infection control in health care personnel. Centers for Disease Control and Prevention. 1998. Fecha de consulta: 4 de diciembre de 2007. Disponible en: http://www.cdc.gov/ncidod/dhqp/gl_hcpersonnel.html. [ Links ]
4. Missouri Bureau of Communicable Disease Control. The Missouri scabies publication; 2000. Fecha de consulta: 12 de diciembre de 2007. Disponible en: http://www.health.state.mo.us/Publications/CDManual/Cdsec38.pdf. [ Links ]
5. Centers for Disease Control and Prevention. Crusted scabies cases (single or multiple); 2008. Fecha de consulta: 22 de octubre de 2010. Disponible en: http://www.cdc.gov/scabies/hcp/crusted.html. [ Links ]
6. Centers for Disease Control and Prevention. Scabies, prevention and control; 2008. Fecha de consulta: 22 de octubre de 2010. Disponible en: http://www.cdc.gov/scabies/prevent.html. [ Links ]
7. Comolli RR, Palacios AM, Bartolini C. Brote epidémico intrahospitalario de escabiosis a partir de un caso de sarna costrosa. Revista del Hospital General de Agudos J. M. Ramos Mejía (Buenos Aires). 2003;VIII(2). Fecha de consulta: 4 de diciembre de 2007. Disponible en: http://www.ramosmejia.org.ar. [ Links ]
8. Michigan Department of Community Health. Scabies Prevention and Control Manual; 2005. Fecha de consulta: 4 de diciembre de 2007. Disponible en: http://www.michigan.gov/documents/scabies_manual_130866_7.pdf. [ Links ]
9. Larrosa A, Cortés-Blanco M, Martínez S, Clerencia C, Urdániz LJ, Urban J, et al. Brote nosocomial de escabiosis en un hospital comarcal de la provincia de Huesca. Boletín Epidemiológico Semanal. 2003;11:285-92. Fecha de consulta: 20 de noviembre de 2006. Disponible en: http://bvs.isciii.es/mono/pdf/bes0346.pdf. [ Links ]
10. Epidemiologic notes and reports scabies in health-care facilities - Iowa. MMWR Morb Mortal Wkly Rep. 1988;37;178-9. Fecha de consulta: 4 de diciembre de 2007. Disponible en: http://www.cdc.gov/mmwr/preview/mmwrhtml/00051539.htm. [ Links ]














