Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 suppl.2 Bogotá Dec. 2010
1 Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia.
2 Grupo de Micología Médica, Instituto Nacional de Cancerología, Bogotá, D.C., Colombia.
3 Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia.
4 Grupo Investigación-clínica, Instituto Nacional de Cancerología, Bogotá, D.C., Colombia.
5 Grupo de Infectología, Instituto Nacional de Cancerología, Bogotá, D.C., Colombia
Recibido: 11/07/2010; Aceptado: 12/11/2010
Resumen
Objetivo: comparar los métodos de referencia de microdilución en caldo de la CLSI M27-A2 y EUCAST, identificando la utilidad y las principales diferencias de cada uno de ellos para los agentes antifúngicos anfotericina B (1), fluconazol (FCZ) e itraconazol (ITZ), contra aislamientos clínicos de Candidaspp. de pacientes con cáncer.
Materiales y métodos: se estudiaron 136 aislamientos de C. albicans, 36 de C. tropicalis y 17 de Candidaspp. Se utilizó el índice Kappa ponderado para medir el grado de acuerdo entre los dos métodos.
Resultados: se estableció que el grado de concordancia entre los dos métodos para el total de los aislamientos fue alto con AB (κ: 1) y FCZ (κ: 0.74) y bajo al utilizar ITZ (κ: 0.49). La concordancia fue variable y especie-específica: para ITZ y FCZ en C. albicans fue de 0,45 y 0,64; en C. tropicalis, de 0,48 y 0,91; y en Candidaspp. de 0,73 y 0,87, respectivamente.
Discusión: este estudio sugiere que las pruebas de sensibilidad antifúngica para los dos métodos son equivalentes en lo esencial. Deben considerarse las diferencias y discrepancias asociadas a la especie implicada, el tipo de antifúngico utilizado y los tiempos de incubación, que puede producir variaciones al interpretar los resultados obtenidos de acuerdo con la metodología empleada.
Palabras claves: agentes antifúngicos/ *farmacología, Candida/*efectos de drogas/aisla- miento y purificación, candidiasis/microbiología, humanos, pruebas de sensibilidad microbiana/ métodos, fluconazol, anfotericina B, itraconazol.
Abstract Objective: compare the broth microdilution testing reference standards CLSI M27-A2 and EUCAST, identifying the usefulness of each one of them and their main differences, against the antifungal agents amphotericin B (1), fluconazole (FCZ), and itraconazole (ITZ) using clinical isolates of Candidaspp. in cancer patients.
Methods: isolates of C. albicans (n=136), C. tropicalis (n=36), and Candidaspp. (n=17) were tested by the two methods. The Kappa index was used to establish the degree of agreement between the methods.
Results: the degree of agreement between the two methods was high for AB (κ: 1) and FCZ (κ: 0.74) and was low for ITZ (κ: 0.49). Agreement was variable and specific for the various species: for ITZ and FCZ in C. albicans, it was 0.45 and 0.64, respectively. In C. tropicalis, it was of 0.48 and 0.91, and in Candidaspp., it was 0.73 and 0.87 respectively.
Discussion: this study suggests that antifungal susceptibility testing using both methods is equivalent. Attention should be focused on differences and discrepancies associated with the species tested, the type of antifungal agent, and the incubation times, which can cause variations at the moment of interpreting the results obtained.
Key words: Antifungal Agents/*pharmacology, Candida/*drug effects/isolation & purification, Candidiasis/microbiology, Humans, Microbial Sensitivity Tests/methods, Fluconazole, Amphotericin B, Itraconazole
Introducción
El incremento en la incidencia de las infecciones invasivas asociadas a especies micóticas, sobre todo en pacientes con algún tipo de inmunocompromiso, así como la disponibilidad de los diferentes agentes antifúngicos, ha subrayado la necesidad de establecer métodos estandarizados para pruebas de sensibilidad antifúngica. éstas deberían permitir, mediante la interpretación de la concentración mínima inhibitoria (CMI), la definición de sensibilidad o resistencia de una especie micótica contra un agente antifúngico específico, de acuerdo con los puntos de corte de interpretación clínica, y ayudar a predecir el potencial terapéutico de agentes antifúngicos nuevos y en desarrollo (2, 3). El objetivo primordial de un estándar de referencia es sentar las bases metodológicas, de manera que se puedan desarrollar metodologías alternas mucho más accesibles, con resultados equivalentes al estándar de referencia y que, considerado de conformidad, su uso sea aceptado. Además, que pueda ofrecer ventajas particulares como facilidad de montaje, lectura e interpretación, y obtención de resultados más rápidos, aspectos que determinan que el nuevo método sea más rentable.
El Instituto de Estándares para el Laboratorio y la Clínica (CLSI por su sigla en inglés) (4) desarrolló la metodología para pruebas de sensibilidad antifúngica para Candidaspp. y Cryptococcus neoformans por microdilución en caldo (Documento M27-A2), como estándar de referencia para evaluar la sensibilidad de diferentes especies micóticas a agentes antifúngicos (4). Con base en estos estudios, el Subcomité para las Pruebas de Sensibilidad Antifúngica (AFST, por su sigla en inglés) de la Unión Europea, de la Sociedad de Microbiología Clínica y Enfermedades Infecciosas (ESCMID, por su sigla en inglés), EUCAST, ha propuesto un método de referencia de microdilución en caldo para determinar la sensibilidad de las levaduras, que fue desarrollado para probar clínicamente aquellas que puedan fermentar significativamente la glucosa, el cual es válido principalmente para Candidaspp. La metodología es similar a la de referencia CLSI M27-A2, pero con modificaciones de los parámetros de la prueba, cuyo objetivo fue obtener lecturas precisas en tiempos más cortos, proporcionando resultados rápidos sin aumentar el costo de las pruebas (5-9).
Materiales y Métodos
Aislamientos clínicos
Se estudiaron en total 189 aislamientos clínicos de la colección de levaduras del Laboratorio de Micología Médica del Instituto Nacional de Cancerología (INC) en Bogotá, Colombia, provenientes de pacientes con cáncer, que habían sido previamente aisladas y conservadas en el cepario de Micología a -70°C, en el periodo comprendido entre 2003 y 2007. Estos aislamientos clínicos se obtuvieron de manera aleatoria de un total de 1073 levaduras pertenecientes a la colección. El tamaño muestral se estableció para calcular un nivel de concordancia de 0,9, con una proporción de casos positivos de 0,12 para CLSI M27-A2 y 0,13 para EUCAST.
Se estudiaron 136 aislamientos de C. albicans, 36 de C. tropicalis, 7 de C. parapsilosis, 5 de C. glabrata, 2 de C. krusei, 1 de C. famata, 1 de C. lusitaniae y 1 de C. guilliermondii. Cada uno representaba una única levadura, de un único paciente y se recuperaron en agar Sabouraud dextrosa (SAB) (Merck, Darmstadt, Germany). Se confirmó nuevamente la identificación de especie previa mediante el método automatizado MicroScan WalKaway96®(Dade Behring, EE.UU.), y adicionalmente mediante CHROMagar CandidaTM ® (Biomerieux, Francia), pruebas de tubo germinal y clamidospora terminal (3).
Pruebas de sensibilidad antifúngica
Se utilizó el método de microdilución en caldo según la metodología recomendada por el documento CLSI M27-A2 (4) y el método de microdilución RPMI 2% de glucosa y lectura espectrofotométrica EUCAST (5) para todos los aislamientos levaduriformes. Como control de calidad se utilizaron las levaduras C. parasilopsis ATCC 22019 y C. krusei ATCC 6258 (10, 11), que se probaron en conjunto con los aislamientos clínicos. Los diversos montajes se llevaron a cabo con las mismas consideraciones técnicas y recomendaciones (4).
Agentes Antifúngicos
Se utilizaron como antifúngicos, AB, (Bristol Meyers Squibb Company, EE.UU., comercial), ITZ, (Janssen Pharmaceutic, Titusville, NJ), y FCZ, (Pfizer Inc., NY). Las soluciones iniciales se prepararon teniendo en cuenta la potencia de cada antifúngico (dato suministrado por el fabricante). El rango de diluciones de los agentes antifúngicos vario de 0,03 µg/ml a 16 µg/ml para ITZ y AB, y de 0,03 µg/ml a 64 µg/ml para FCZ.
Preparación del inóculo
Para las pruebas de sensibilidad antifúngica se siguieron estrictamente las pautas de las guías de CLSI M27-A2 y EUCAST(4, 9). Los inóculos de trabajo se prepararon en solución salina a partir de cultivos previos de las levaduras, de 24 horas de incubación en agar SAB, y se ajustó su turbidez mediante lectura espectrofotométrica a 0,5 en la escala de McFarland. La concentración final de la suspensión del inóculo fue de 0,4X104 - 5X104 UFC/ml para la metodología CLSI M27-A2 y de 1X106 - 5X106 UFC/ml, para la metodología del EUCAST. Se verificó la suspensión mediante un recuento cuantitativo de colonias en agar SAB.
Método de microdilución en caldo CLSI (Documento M27-A2): se utilizaron placas de microdilución de 96 pozos de fondo en U que contenían 100 µl de las diluciones seriadas del antifúngico por ensayar (AB, FCZ, VCZ) en medio RPMI 1640 (0,2 % glucosa). Se agregaron 100 µl del inóculo de acuerdo con la concentración final recomendada. Después de inocular las placas, éstas se incubaron a 35°C. La lectura de CMI se realizó a las siguientes 24 y 48 horas. La lectura de la CMI correspondió a la dilución del antifúngico que mostró una inhibición importante del crecimiento (50% o más para FCZ e ITZ; 100% para AB). Las levaduras de control de calidad se ensayaron en conjunto con los aislamientos clínicos (3).
Método de microdilución en caldo EUCAST: Se utilizaron placas de microdilución de 96 pozos de fondo plano que contenían 100 µl de las diluciones seriadas del antifúngico por ensayar en medio RPMI 1640 (2% glucosa); se agregaron 100 µl del inóculo de acuerdo con la concentración final recomendada. éstas se incubaron en atmósfera húmeda a 35°C. La lectura de las CMI se realizó a las siguientes 24 horas. La CMI de los diferentes agentes antifúngicos, se determinó por el método espectrofotométrico a partir de la densidad óptica (DO) a 405 nm de cada uno de los pozos en un lector de microplacas (Multiskan MCC/340®). Para AB se consideró como CMI la concentración de fármaco con la menor DO, que corresponde al 100% de inhibición de crecimiento. Para los azoles (FCZ, ITZ), la CMI consideró la concentración de fármaco que causa el 50% de inhibición de crecimiento (12).
Lectura e Interpretación de las CMI: la interpretación de los puntos de corte para ambos métodos se basó en los perfiles recomendados por el documento CLSI M27-A2 para determinar el Sensible (S), el Sensible Dependiente de Dosis (SDD) y el Resistente (R). Para el FCZ se consideró como S, CMI: < 8 µg/ml, SDD, CMI: 16-32 µg/ml y R, CMI: >64 µg/ml; para ITZ como S, CMI: <0.125 µg/ml, SDD, CMI: 0.25-0.5 µg/ml, y R, CMI: >1 µg/ml (4, 13). Dado que el documento no establece claramente los puntos de corte para la AB, se consideró que las levaduras eran probablemente sensibles cuando sus CMI fueron <1 µg/ml y como probablemente resistentes aquellas con CMI >1 µg/ml.
Análisis estadístico
Se diseñó un estudio de concordancia de pruebas diagnósticas para comparar los perfiles de sensibilidad y resistencia de tres agentes antifúngicos (FCZ, ITZ y AB), medidos con dos métodos de referencia por microdilución en caldo, de acuerdo con las recomendaciones de CLSI M27-A2 y de EUCAST. Para los procedimientos estadísticos se empleó el programa STATA® 8.
Para comparar los dos métodos se utilizaron las CMI obtenidas a las 24 horas de incubación para EUCAST y a las 24-48 horas de incubación para CLSI M27-A2. El acuerdo entre los métodos se consideró cuando la discrepancia en las CMI no superó 2 log2 de diluciones de diferencia (es decir, no debió sobrepasar dos diluciones).
El grado de concordancia de los perfiles de sensibilidad en los dos métodos se halló utilizando el índice Kappa ponderado (14, 15) y la correlación entre los resultados de las dos pruebas, medidos en términos de µg/ml. Se evaluó mediante el coeficiente de correlación intraclase (CCI).
Resultados
Los porcentajes totales de sensibilidad in vitro de los 189 aislamientos a los tres agentes antifúngicos analizados, por los dos métodos (CLSI M27-A2 - EUCAST) se listan en la tabla 1. Al comparar los perfiles de resistencia, se encontró 29,6% (CLSI M27-A2) frente a 37,0% (EUCAST) al utilizar FCZ; y 26,5% (CLSI M27-A2) frente a 14,8% (EUCAST) al utilizar ITZ.

La tabla 2 muestra el grado de concordancia entre los métodos utilizados (CLSI M27-A2 -EUCAST) en las diferentes especies estudiadas, por medio del índice Kappa ponderado. El grado de concordancia en general fue bajo para ITZ y de moderado a bueno frente a FCZ con todos los aislamientos levaduriformes ensayados. Sin embargo, al revisar el comportamiento de acuerdo con una especie-específica, se observó que en el caso particular del FCZ y C. tropicalis (Kappa: 0,91) y Candidaspp. (Kappa:0,87), ambos métodos mostraron una buena correlación.

En la tabla 3 se muestran los datos del Coeficiente de Correlación Intraclase (CCI). En general, se observó un CCI bajo con todos los aislamientos ensayados frente a la AB (CCI:0.297) y el ITZ (CCI: 0,445). Al revisar las especies de manera particular, para el caso del FCZ y C. tropicalis (CCI: 0.837) y Candidaspp. (CCI: 0.812), se obtuvo un CCI excelente.

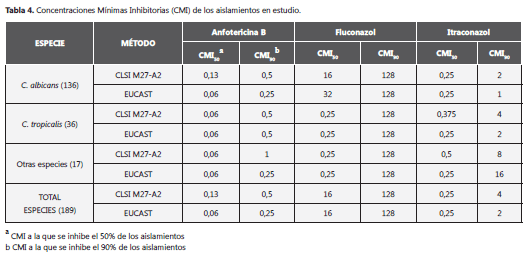
La tabla 4 presenta las CMI50 CMI90 obtenidas luego de la lectura de las CMIs para ambos métodos, de acuerdo con el periodo de incubación recomendado eb cada método. En el caso particular del FCZ, la CMI90 (CMI: 128 µg/ml) fue igual al hacer el estudio general de todos los aislamientos y de manera particular para cada especie levaduriforme en estudio.
Discusión
Las pruebas de sensibilidad a los antimicóticos no sólo deben proporcionar datos reproducibles sino tener la capacidad de identificar aquellas especies que son potencialmente resistentes a un agente antifúngico específico. Desde su introducción en 1997, la metodología CLSI M27-A2 ha estado disponible y ha llegado a ser considerada como un método de referencia confiable y reproducible, aunque presente limitaciones, de las cuales las principales son: crecimiento paradójico (conocido como efecto trailing), cuando se utilizan agentes antifúngicos de tipo azólico; detección poco confiable de aquellas especies verdaderamente resistentes, de manera particular con la AB; tiempos de incubación más largos; y el empleo de una lectura visual que hace que la determinación de las CMI correspondientes sean subjetivas (5, 7). Sin embargo, el CLSI M27-A2 se considera un método de referencia a partir del cual se han podido desarrollar métodos alternativos más objetivos, prácticos y rápidos para su uso en el laboratorio clínico de rutina. El objetivo del subcomité de AFST del EUCAST fue proponer una modificación de este método de referencia que incluye: el suplemento al medio RPMI 1640 (2% de glucosa) y el uso de un tamaño de inóculo de trabajo diferente (1X106 - 5X 106 UFC/ml), cuya finalidad es obtener un mejor crecimiento de la levadura, lo que junto a la implementación de la lectura espectrofotométrica permite simplificar la determinación e interpretación de las CMI (11) y realizar la prueba de sensibilidad antimicótica de una manera más fácil y comprensible (15,16).
Además de establecer una nueva metodología de referencia, para determinar los puntos de corte europeos y establecer las normas de expertos en la interpretación clínica de estas pruebas, el EUCAST también se propuso producir resultados concordantes con los obtenidos al utilizar la metodología CLSI M27-A2, y al optar por trabajar de manera conjunta, establecer normas en común de ambos métodos considerados como referentes. Las dos metodologías difieren en varios aspectos importantes, por lo que podría esperarse que sus resultados presenten grandes diferencias a la hora de interpretar las lecturas de la CMI (17,18). Debido a las modificaciónes introducidas, existen reportes que sugieren que el suplemento de glucosa no es considerado un factor importante para estimular el crecimiento levaduriforme, como sí lo es el tamaño del inóculo, que puede introducir errores a la hora de interpretar las lecturas de las CMI, en los tiempos de incubación recomendados y hacer discutibles algunos de sus resultados.
Al hacer el estudio inicial de los perfiles de sensibilidad antifúngica, comparando las metodologías CLSI M27-A2 vs EUCAST, en general FCZ e ITZ mostraron porcentajes de resistencia superiores a los establecidos en reportes internacionales similares y claras diferencias de acuerdo con la metodología empleada (15). Estudios colombianos de pruebas de sensibilidad antifúngica, realizados en pacientes con cáncer e infección fúngica invasiva (12), han señalado que en nuestro país se manejan porcentajes de resistencia más elevados en comparación con reportes internacionales en los que el tipo de paciente, su enfermedad de base, el grado de invasividad de la especie implicada o los antecedentes de tratamiento pueden explicar este tipo de resultados. Estudios hechos en otros países han identificado el cáncer como un factor de riesgo para el desarrollo de resistencia al fluconazol (16, 17), lo que explicaría la situación específica de esta institución dedicada al manejo de dicho tipo de pacientes.
En cuanto a su comportamiento especie-específica, en el caso de C. albicans frente a FCZ (8,9% de diferencia entre los dos métodos) y a ITZ (casi 20% de diferencia) y C. tropicalis frente a FCZ (5,5% de diferencia) e l ITZ (diferencia superior al 100%), muestran claras variaciones en la categorización de los resistentes (7, 13). Los resultados obtenidos, en el caso del FCZ con un número mayor de levaduras categorizadas como resistentes, y usando la metodología EUCAST; y el ITZ con un número mayor de reporte de levaduras categorizadas como resistentes, y la metodología CLSI M27-A2, establecen un comportamiento similar a los estudios de grupos como el de Espinel y colaboradores (18), aun cuando éstos presenten porcentajes de resistencia menores. Al estudiar el comportamiento de la AB, de manera similar con los resultados obtenidos por Cuenca-Estrella y colaboradores, se obtuvo una sensibilidad óptima de dicho agente antifúngico al evaluarlo por los dos métodos, incluso teniendo presente que hasta el momento, no existe consenso en el tipo de metodología óptima para identificar aquellas especies resistentes o para la interpretación clínica de las diferentes CMI obtenidas (5, 7). Es decir, que parte de la falta de identificación de diferencias entre los dos métodos puede estribar en un bajo recuento de cepas resistentes, a partir de las cuales se podrían encontrar éstas, como sucede en nuestro estudio.
Al tratar de establecer el grado de correlación entre las dos metodologías, CLSI M27-A2 vs EUCAST, nuestros resultados muestran, en general, concordancia perfecta con la AB (Kappa: 1) y concordancia baja con el ITZ (Kappa 0,49); el grado de correlación al comparar especies-específicas del FCZ con C tropicalis (Kappa: 0,91) y Candida spp. (Kappa: 0,87) y del ITZ con C. albicans (Kappa: 0,45) y C. tropicalis (Kappa: 0,48), muestran que el grado de correlación entre los métodos dependió, en nuestro estudio, de la especie implicada y el agente antifúngico evaluado. La literatura ha reportado, en general, un grado de acuerdo bajo (58,5%) al utilizar ITZ y grados de acuerdo más altos con el FCZ. Estudios similares, han evaluado la reproducibilidad de las dos metodologías y, en general, sus resultados son buenos (varían entre 85 y 95% dependiendo de la especie, del agente antifúngico y el tiempo de incubación) (5, 7, 18), si bien la metodología EUCAST tiende a producir lecturas de CMI menores y con grados de acuerdos muy pobres por el agente antifúngico ensayado. Este tipo de hallazgos, similares a los obtenidos en nuestro estudio, hacen difícil establecer puntos en común al interpretar los datos de las CMI, obtenidas por ambas metodologías (5, 19). Estudios recientes han confirmado que las pruebas con intraconazol tienen importantes limitaciones de reproducibilidad, muy probablemente en relación con su características de hidrofobicidad (20).
En la mayoría de los estudios disponibles en la literatura, para determinar el grado de concordancia entre las metodologías se utilizaron porcentajes de acuerdo, a diferencia del nuestro, que utilizó el índice kappa ponderado. Esto nos permitió realizar estimaciones más exactas al descontar el artificio generado por la probabilidad de concordancia por azar. En general, al analizar los datos obtenidos en nuestro estudio se observaron dos tipos de concordancias: por antifúngico, en el que ITZ fue el más bajo; y por especie levaduriforme, en el cual C. albicans presentó los valores más bajos (FCZ, Kappa: 0,67; ITZ Kappa: 0,45). Como se mencionó, las diferencias con otros estudios realizados pueden residir en la posibilidad de tener un mayor número de aislamientos resistente(7, 18, 21). En el caso de anfotericina B, cuya resistencia es 0%, la concordancia es mayor, mientras que la frecuencia de cepas resistentes a fluconazol en los aislamientos de C. albicans y C. tropicalis es superior a la identificada en nuestro medio (1), por supuesto en pacientes sin cáncer. Es decir, en la medida en que los métodos sean capaces de identificar aislamientos con un comportamiento diferente, son más evidentes los problemas de concordancia.
Al evaluar el acuerdo a través del CCI, se observó un mejor desempeño con fluconazol que con itraconazol y, a su vez, mayor con éste que con anfotericina. Estudios internacionales de CCI (17) con FCZ, en general, mostraron grados de variabilidad más altos a los obtenidos en nuestro estudio para este agente antifúngico, aunque en el caso de C. tropicalis y Candidaspp. fueron similares los resultados de las CCI. Los resultados de este estudio, demostraron que había diferencias importantes entre los resultados de las CMI de las dos metodologías que fueron confirmados por CCI hallados y pueden influir en la interpretación clínica de los mismos resultados.
En conclusión, los resultados obtenidos por la metodología de la CLSI M27-A2 y el EUCAST para la lectura e interpretación de sus CMI parecen ser equivalentes en lo esencial, especialmente para FCZ y C. tropicalis. Sin embargo, debe considerarse cualquier diferencia que pudiera existir entre los puntos de corte establecidos por el CLSI M27-A2 y los adoptados por el EUCAST; debe tomarse con precaución la información relacionada con la susceptibilidad en los escenarios donde hay menor acuerdo: itraconazol, probablemente en relación con su hidrofobicidad, y anfotericina B debido a la incapacidad para identificar cepas “resistentes”. Es muy probable que se requiera validación clínica para aplicar las pruebas de susceptibilidad en estos escenarios, especialmente para el uso de la técnica EUCAST, ya que la información disponible avala en el uso de los puntos de corte los resultados de CLSI (22).
Conflicto de intereses
No hay conflictos de interés que señalar por parte de los autores.
Financiación Este estudio fue financiado a través del Instituto Nacional de Cancerología ESE.
Correspondencia: Jorge Alberto Cortés. Dirección: Facultad de Medicina, Of. 510, Universidad Nacional de Colombia, Calle 45, carrera 30, Ciudad Universitaria, Bogotá, D.C., Colombia. Teléfono: (57) 1 3165000 Ext. 15011. Dirección electrónica: jorgecortes@yahoo.com
Referencias
1. De Bedout C, Ayabaca J, Vega R, Méndez M, Santiago AR, Pabon ML, et al. Evaluación de susceptibilidad de especies de Candida al fluconazol usando el métodos de difusión en disco. Biomédica. 2003;23:31-7. [ Links ]
2. Rex JH, Pfaller MA, Walsh TJ, Chaturvedi V, Espinel-Ingroff A, Ghannoum MA, et al. Antifungal susceptibility testing: practical aspects and current challenges. Clin Microbiol Rev. 2001;14:643-58. [ Links ]
3. Finquelievich JL. Candidiasis. En: Restrepo A, Robledo J, Leiderman E, Restrepo M, Botero D, Bedoya V, editores. Enfermedades infecciosas, sexta ed. Medellín: CIB; 2003. p. 268-74. [ Links ]
4. Clinical and Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeasts. Approved Standards M27-A2. Wayne, Pa.:National Committe for Clinical Laboratory Standards: 2002. [ Links ]
5. Cuenca-Estrella M, Moore CB, Barchiesi F, Bille J, Chryssanthou E, Denning DW, et al. Multicenter evaluation of the reproducibility of the proposed antifungal susceptibility testing method for fermentative yeasts of the Antifungal Susceptibility Testing Subcommittee of the European Committee on Antimicrobial Susceptibility Testing (AFST-EUCAST). Clin Microbiol Infect. 2003;9:467-74. [ Links ]
6. Cuenca-Estrella M, Diaz-Guerra TM, Mellado E, Rodriguez-Tudela JL. Influence of glucose supplementation and inoculum size on growth kinetics and antifungal susceptibility testing of Candida spp. J Clin Microbiol. 2001;39:525-32. [ Links ]
7. Cuenca-Estrella M, Lee-Yang W, Ciblak MA, Arthington-Skaggs BA, Mellado E, Warnock DW, et al. Comparative evaluation of NCCLS M27-A and EUCAST broth microdilution procedures for antifungal susceptibility testing of Candida species. Antimicrob Agents Chemother. 2002;46:3644-7. [ Links ]
8. Cuenca-Estrella M, Rodero L, Garcia-Effron G, Rodriguez-Tudela JL. Antifungal susceptibilities of Candida spp. isolated from blood in Spain and Argentina, 1996-1999. J Antimicrob Chemother. 2002;49:981-7. [ Links ]
9. EUCAST definitive document EDef 7.1: method for the determination of broth dilution MIC of antifungal agents for fermentative yeasts. Clin Microbiol Infect. 2008;14:398-405. [ Links ]
10. Pfaller MA, Bale M, Buschelman B, Lancaster M, Espinel-Ingroff A, Rex JH, et al. Selection of Candidate quality control isolates and tentative quality control ranges for in vitro susceptibility testing of yeast isolates by National Committee for Clinical Laboratory Standards proposed standard methods. J Clin Microbiol. 1994;32: 1650-3. [ Links ]
11. Pfaller MA, Yu WL. Antifungal susceptibility testing. New technology and clinical applications. Infect Dis Clin North Am. 2001;15: 1227-61. [ Links ]
12. Rivas P. Antifungal susceptibility testing in clinical isolates of Candida spp from patients with cancer. Rev Colomb Cancerol. 2004;8: 22 -8. [ Links ]
13. Rex JH, Pfaller MA, Galgiani JN, Bartlett MS, Espinel-Ingroff A, Ghannoum MA et al. Development of interpretive breakpoints for antifungal susceptibility testing: conceptual framework and analysis of in vitro-in vivo correlation data for fluconazole, itraconazole, and Candida infections. Subcommittee on Antifungal Susceptibility Testing of the National Committee for Clinical Laboratory Standards. Clin Infect Dis. 1997;24:235-47. [ Links ]
14. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics 1977;33:159-74. [ Links ]
15. Cohen J. Weighted kappa: nominal scale agreement with provision for scaled disagreement or partial credit. Psychol Bull. 1968;70:213- 20. [ Links ]
16. Takakura S, Fujihara N, Saito T, Kudo T, Iinuma Y, Ichiyama S. Clinical factors associated with fluconazole resistance and short-term survival in patients with Candida bloodstream infection. Eur J Clin Microbiol Infect Dis. 2004;23:380-8. [ Links ]
17. Slavin MA, Sorrell TC, Marriott D, Thursky KA, Nguyen Q, Ellis DH et al. Candidaemia in adult cancer patients: risks for fluconazole-resistant isolates and death. J Antimicrob Chemother. 2010;65:1042-51. [ Links ]
18. Espinel-Ingroff A, Barchiesi F, Cuenca-Estrella M, Pfaller MA, Rinaldi M, Rodriguez-Tudela JL et al. International and multicenter comparison of EUCAST and CLSI M27-A2 broth microdilution methods for testing susceptibilities of Candida spp. to fluconazole, itraconazole, posaconazole, and voriconazole. J Clin Microbiol. 2005;43:3884-9. [ Links ]
19. Odds FC, Vranckx L, Woestenborghs F. Antifungal susceptibility testing of yeasts: evaluation of technical variables for test automation. Antimicrob Agents Chemother. 1995;39:2051-60. [ Links ]
20. Gomez-Lopez A, Arendrup MC, Lass-Floerl C, Rodriguez-Tudela JL, Cuenca-Estrella M. Multicenter comparison of the ISO standard 20776-1 and the serial 2-fold dilution procedures to dilute hydrophilic and hydrophobic antifungal agents for susceptibility testing. J Clin Microbiol. 2010;48:1918-20. [ Links ]
21. Rodriguez-Tudela JL, Berenguer J, Martinez-Suarez JV, Sanchez R. Comparison of a spectrophotometric microdilution method with RPMI-2% glucose with the National Committee for Clinical Laboratory Standards reference macrodilution method M27-P for in vitro susceptibility testing of amphotericin B, flucytosine, and fluconazole against Candida albicans. Antimicrob Agents Chemother. 1996;40:1998-2003. [ Links ]
22. Lee SC, Fung CP, Huang JS, Tsai CJ, Chen KS, Chen HY, et al. Clinical correlates of antifungal macrodilution susceptibility test results for non-AIDS patients with severe Candida infections treated with fluconazole. Antimicrob Agents Chemother. 2000;44:2715-8. [ Links ]














