Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.15 no.3 Bogotá July/Sept. 2011
1Hospital Departamental de Villavicencio, Villavicencio, Colombia
2Grupo de Investigación de Villavicencio, Villavicencio, Colombia
3Universidad Cooperativa de Colombia, Villavicencio, Colombia
Recibido: 02/06/2011; Aceptado: 03/08/2011
Resumen
Objetivo. Analizar la resistencia de Escherichia coli a los antibióticos de acuerdo con la presencia de beta-lactamasas de espectro extendido (BLEE).
Materiales y métodos. Estudio descriptivo y de corte transversal, en el Hospital Departamental de Villavicencio, centro de atención de mediana y alta complejidad. La población de estudio fueron los pacientes con cultivos positivos para E. coli. La variable de estudio fue la resistencia a ceftazidima, cefotaxima y clavulanato. Se confirmó la presencia de BLEE y la resistencia a otros antibióticos.
Resultados. Se tamizaron 29.451 estudios de microbiología, de los cuales 26,7 % fueron positivos. Se identificaron 77,6 % como Gram negativos y 2.551 (41,8 %) como E. coli. De los cultivos, 65,1 % se obtuvieron de orina; 9,5 % fueron resistentes a ceftazidima y 8,7 % a cefotaxime. En los aislamientos de orina, la resistencia de E. coli a ceftazidima fue de 6,5 %, mientras que, en aspirados traqueales, fue de 35,0 % (OR=7,98; p<0,05). Se hicieron 315 pruebas confirmatorias para BLEE con equipo Vitek® y 506 con AutoScan®. La mayor cantidad de muestras se obtuvieron de la consulta externa (34,0 %) y, aunque allí se encontró un número significativo de BLEE (6,9 %), hubo mayor resistencia en la unidad neonatal (16,9 %). La resistencia a ampicilina, cefalotina, ciprofloxacina, gentamicina y trimetoprim-sulfametoxazol, fue alta. El 7,1 % de las pruebas confirmatorias con clavulanato fueron positivas para BLEE.
Conclusiones. El estudio demostró una frecuencia de 7,1 % de BLEE en esta institución. Hubo servicios con mayor riesgo, como el de neonatos, aunque el fenómeno no se limitaba al ambiente hospitalario. También, se encontró un pequeño porcentaje que fue resistente a carbapenem.
Palabras clave: pruebas de sensibilidad microbiana, Escherichia coli, humanos, fenotipo, beta-lactamasas, Colombia.
Abstract
Objective: To analyze antimicrobial resistance of Escherichia coli according to the presence of extended spectrum beta-lactamase.
Design: A cross sectional descriptive study.
Setting: Hospital Departamental de Villavicencio, a State center of second and tertiary care.
Study population: Positive cultures for E. coli were analyzed between September 2005 and November 2009.
Interventions: None.
Study variable: Ceftazidime and cefotaxime resistance with and without clavulanate.
Outcomes: Confirmation of ESBL test and resistance to other antimicrobials.
Results: From the 29,451 microbiological samples that were screened, 26.7% were positive. 77.6% were identified as Gram negative and 2,551 (41.8%) were typified as E. coli. 65.1% isolations were from urine samples and 9.5 and 8.7% of them were resistant to ceftazidime and cefotaxime, respectively. 6.5% of urine samples were resistant to ceftazidime, but it raised to 35% for tracheal aspirate (OR 7.98 p<0.05). Three hundred and fifteen confirmatory tests for ESBL were performed with Vitek® and 506 with AutoScan®. Most samples were ambulatory patients (34.0%) and a significant number of them were positive for ESBL (6.9%), but it was higher at the newborn ward (16.9%). Resistance was high for antimicrobials commonly used for infections by this microorganism such as ampicillin, cephalothin, ciprofloxacin, gentamycin and trimethoprim-sulfamethoxazole. Confirmatory ESBL test was 7.1%.
Conclusions: The study demonstrates a 7.1% frequency of ESBL at this hospital but the samples from newborn ward showed a higher frequency of ESBL; nevertheless, the issue is not restricted to hospitalized patients. We also found a small number of isolations resistant to carbapenem.
Key words: Microbial sensitivity tests, Escherichia coli, humans, phenotype, beta-lactamases, Colombia.
Introducción
El aumento de la resistencia bacteriana a los antibióticos es motivo de gran preocupación ya que dificulta el enfoque terapéutico de los pacientes infectados (1, 2, 3). La producción de betalactamasas de espectro extendido (BLEE) en las enterobacterias se ha encontrado asociada a la capacidad de hidrolizar varios antimicrobianos, incluso de familias diferentes a los betalactámicos (4). También, se ha observado un aumento de la mortalidad en presencia de BLEE, aunque es menos frecuente en infecciones por Escherichia coli que con otras enterobacterias (5,6).
Las propiedades fenotípicas de las bacterias con capacidad de producción de BLEE son de gran importancia para su estudio en el laboratorio de microbiología y su aproximación terapéutica (7,8,9,10,11). Se requiere conocer los mecanismos de resistencia, como la producción de BLEE, en cada institución, a fin de establecer estrategias y políticas para su control, entre ellas el uso racional de los antimicrobianos (8,12).
Varios investigadores en Colombia y América Latina han publicado sus hallazgos (13,14,15,16,17,18,19,20, 21,22), que reflejan la magnitud creciente de este problema, que ha pasado de 9 % en 2003 a 26 % en 2007 (23,24,25,26,27).
El Hospital Departamental de Villavicencio, donde se llevó a cabo este estudio, es un centro que ofrece servicios de atención en salud de mediana y alta complejidad a la población de la Orinoquia colombiana y ha hecho esfuerzos para racionalizar el uso de antibióticos (28,29). El objetivo del estudio fue analizar la resistencia de E. coli a los antibióticos de acuerdo con la presencia de beta-lactamasas de espectro extendido, identificada con pruebas de resistencia a la ceftazidima y cefotaxime o con pruebas confirmatorias en el equipo automatizado.
Materiales y métodos
Diseño del estudio. Se trata de un estudio de corte transversal llevado a cabo desde septiembre de 2005 hasta noviembre de 2009.
Población de estudio. Se tomaron las muestras enviadas para cultivo de los pacientes hospitalizados y ambulatorios del Hospital Departamental de Villavicencio, un centro de alta complejidad del sector público.
Se tamizaron todas las muestras de los estudios microbiológicos en el periodo, a fin de recolectar las que cumplían con el criterio de inclusión. El criterio de inclusión fue la identificación de los aislamientos como E. coli. El criterio de exclusión fue que no se les hubiera realizado a los cultivos el antibiograma o que no estuviera registrada ninguna de las concentraciones inhibitorias mínimas (CIM).
Recolección de datos. Se tomó la información de la base de datos del Laboratorio de Microbiología desde septiembre de 2005 hasta noviembre de 2009 y se buscaron los aislamientos que habían sido positivos para el microorganismo estudiado.
Las muestras se procesaron según los requisitos del Clinical and Laboratory Standards Institute (CLSI) (30,31) en equipo Vitek® (Biomerieux, Inc., Hazelwood, MO) y en equipo AutoScan-4 Walkaway® (Siemens Healthcare Diagnostics Inc., West Sacramento, CA) durante el período del estudio.
El punto de corte para la sensibilidad de ceftazidima fue 8 µg/ml y para resistencia de 32 µg/ ml, y para cefotaxima, de 8 µg/ml y 64 µg/ml, respectivamente. Todos los aislamientos en la zona intermedia fueron incluidos en el grupo de resistentes.
La determinación de beta-lactamasa de espectro extendido se hizo mediante la prueba de resistencia a cefalosporina de tercera generación (ceftazidima o cefotaxime) y, la prueba confirmatoria en microcaldo con asociación de cefalosporina de tercera generación y clavulanato, con el equipo Vitek ® en 2005 y con el AutoScan® desde 2009 con el panel Combo 50 y 51® (32).
Análisis estadístico. Los datos recolectados durante el periodo de estudio fueron exportados al programa Whonet, versión 5.5 (33).Los análisis de estadística descriptiva se hicieron en este programa y, el análisis univariado y bivariado, en el programa Episet, versión 1.1, según la resistencia a la ceftazidima como prueba de tamización para BLEE (34). La variable de estudio fue la resistencia a las cefalosporinas de tercera generación, ceftazidima o cefotaxime.
Para efectos del estudio, se definieron como "ambulatorias" las muestras tomadas en el servicio de consulta externa y urgencias. Las muestras de los servicios hospitalarios y de la unidad de cuidados intensivos se analizaron como "hospitalarias".
Los desenlaces estudiados fueron: el resultado positivo de la prueba confirmatoria de BLEE con ceftazidima-clavulanato o cefotaxime-clavulanato, cuando fue realizada, y la resistencia asociada a otros antibióticos. También, se analizaron los resultados por servicio y tipo de muestra.
Los aislamientos de la unidad de cuidados intermedios y de la unidad de cuidados intensivos de adultos, se analizaron como uno solo, debido a su funcionamiento conjunto en la institución.
Para la comparación estadística, se usó la prueba de ï2 con el test de Fisher según correspondiera y se definió como significativa cuando p era menor o igual a 0,05.
Aspectos éticos. Debido a que se trataba de un estudio retrospectivo, sin intervención y sin riesgo para los pacientes, ya que sólo se usaron los datos del Laboratorio de Microbiología, no se requirió del consentimiento informado (35). El estudio fue aprobado por la institución y se mantuvo la confidencialidad de la identidad de los pacientes.
Resultados
Durante este periodo de estudio, se tamizaron 29.451 muestras, de las cuales, 26,7 % resultaron positivas. El 77,6 % fueron Gram negativas y 2.551 (41,8 %) se tipificaron como E. coli. De estas últimas, 95,5 % tuvieron reporte de concentración inhibitoria mínima (CIM) para la mayoría de los antibióticos. El 9,5 y el 8,7 % de las muestras con E. coli fueron resistentes a la prueba con ceftazidima y cefotaxime, respectivamente.
Durante los años 2005 y 2006, se hicieron 108 y 207 pruebas confirmatorias de BLEE, respectivamente, en el equipo Vitek®. Durante el 2009, se usó el panel confirmatorio de BLEE con ácido clavulánico en el equipo AutoScan®, en 499 pacientes, pero sólo en siete en el 2008 (tabla 1).
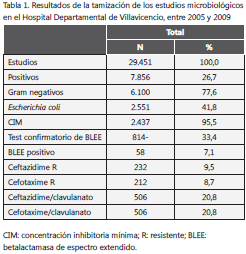
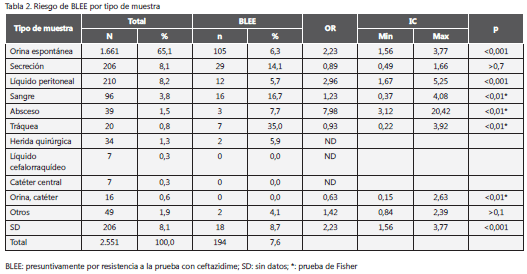
Las muestras se recolectaron, principalmente, de orina mediante micción espontánea (65,1 %), seguida por líquido peritoneal y otras secreciones (8,2 y 8,1 %, respectivamente) y de los servicios de consulta externa, hospitalización y urgencias (34,0, 30,7 y 25,7 %, respectivamente). El 35,0 % de las muestras de aspirado traqueal, 16,7% de sangre, 14,5% de otras secreciones y 6,3% de las orinas, se evaluaron con la prueba confirmatoria de BLEE, mientras que por servicios, fueron 16,9 % en neonatos y menos de 10 % en los otros servicios. Los aislamientos de aspirado traqueal fueron más frecuentemente resistentes a la ceftazidima que los de orina (35,0 Vs. 6,3 %; OR=7,98; p<0,001) al igual que los hemocultivos (16,7 %; OR=2,96; p<0,001) y otras muestras que fueron rotuladas como secreción sin mayor especificación (14,1 %; OR=2,23; p<0,001), mientras que las de líquido peritoneal fueron de 5,7 % (tabla 2).
La resistencia de E. coli a la ceftazidima fue significativamente mayor en la unidad neonatal que en otros servicios (16,9 Vs. 6,9 %; OR: 2,27; p<0,01) (tabla 3). La resistencia concomitante a otros antibióticos, incluso diferente a los betalactámicos, cefamicinas y carbapenemicos, fue mayor en los casos sospechosos de ser productores de BLEE (OR=4,1-23,6).

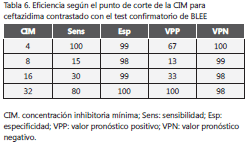
En la tabla 6 se muestran los aislamientos según los puntos de corte de 2009 y llama la atención la alta resistencia a antibióticos que aún son usados con frecuencia en algunos servicios en infección por E. coli, como la ampicilina (68,7 %), la cefalotina (37,7 %), la ciprofloxacina (33,5 %), la gentamicina (23,6 %) y el trimetoprim-sulfametoxazol (55 %), así como el buen comportamiento de la nitrofurantoina (4,5 %). El 7,1 % de las pruebas confirmatorias para BLEE fueron positivas. Como era de esperarse, se encontró que, a mayor CIM, la prueba confirmatoria para BLEE fue positiva con mayor frecuencia; fue de 100 % con 32 µg/ml (41/41), 33,3 % con 16 µg/ml (3/9), 12,5 % con 8 µg/ml (1/8), 66,7 % con 4 µg/ml (6/9) y 0,0 % con 2 µg/ml.
Al discriminar las muestras de orina, se observó que la resistencia fue más frecuente en pacientes ambulatorios (urgencias y consulta externa) que en hospitalizados, para ampicilina (70,7 Vs. 63,9 %), ciprofloxacina (41,0 Vs. 24,1 %), gentamicina (20,7 Vs. 15,4 %) y trimetoprim-sulfametoxazol (60,0 Vs. 50,2 %) (tabla 6).
Discusión
La resistencia bacteriana es variable entre regiones geográficas, inclusive dentro de un mismo país y entre instituciones en una misma ciudad (36). La vigilancia de estos patrones permite conocer los mecanismos de resistencia predominantes aun por servicios, lo cual, a su vez, facilitaría la toma de decisiones terapéuticas (37).
El presente estudio demostró una baja frecuencia de resistencia mediada por BLEE en E. coli, en contraste con otros países (38), pero, aún así, también se encontró que hay servicios con mayor neonatal.
El aislamiento de 6,9 % de E. coli con patrón de BLEE en la consulta externa, sugiere que probablemente este fenómeno no está limitado al ambiente hospitalario, como ya se ha reportado en otras regiones de América Latina y fuera del continente (39,40,41,42,43,44), lo cual debe tenerse en cuenta por sus implicaciones terapéuticas, aun en pacientes con infecciones extrahospitalarias (45,46). Tal es el caso de las peritonitis, cuyo microorganismo más frecuente es precisamente E. coli y cuya evaluación microbiológica no se hace rutinariamente (47), iniciando antibióticos de forma empírica que, frente a estos resultados, podrían tener una posibilidad de fracaso terapéutico (5,7 %).
Otras causas que alteran los resultados de la prueba confirmatoria de BLEE deben tenerse en cuenta para el estudio y en el abordaje clínico, como la presencia de bacterias con capacidad de producción exagerada de enzimas codificadas por medio de los cromosomas, así como la presencia de otras enzimas hidrolíticas que no fueron analizadas en el presente estudio, ya que la resistencia encontrada a las cefamicinas (cefoxitin) y a los carbapenems, pudiera deberse a otros mecanismos, como AmpC o carbapenemasas, y estos alteran la prueba para BLEE en los métodos automatizados usados en el estudio (tabla 4), (48,49,50,51,52,53).

Aunque el 100 % de las muestras con CIM mayor o igual a 32 µg/ml fueron confirmadas para BLEE, el hallazgo de pruebas positivas en puntos de corte menores debe alertar a los médicos en las decisiones terapéuticas, ya que las bacterias en rangos sensibles pueden ser portadoras de BLEE, lo cual hace indispensable la prueba confirmatoria en forma sistemática (tabla 5) (54). La decisión de disminuir los puntos de corte de las cefalosporinas, propuesto recientemente por el CLSI, ha generado gran discusión académica y será un proceso que tomará tiempo para su implementación, lo que nos obliga a seguir utilizando todavía esta prueba confirmatoria como una herramienta indispensable para establecer la presencia de BLEE y la adecuada selección antibiótica (55). Por último, debe llamar la atención el hallazgo de una alta resistencia en pacientes ambulatorios para antimicrobianos frecuentemente usados en ellos.

El estudio tiene limitaciones al no poder asociar los resultados con los desenlaces clínicos ni discriminar entre los aislamientos de los pacientes colonizados de los verdaderamente infectados, y por aspectos ligados a su diseño (retrospectivo, falta de control de variables). Otra limitación es la falta de confirmación de todos los aislamientos sospechosos para BLEE durante los años 2007, 2008, y aun en el 2009, debido al tipo de panel que se usó en esa época y a la limitación para confirmar con métodos más específicos, como PCR, los hallazgos con un estándar.
Estos resultados, sin embargo, permiten conocer el comportamiento de la epidemiología microbiana local y es una herramienta que permitirá determinar guías de manejo propias para el uso racional de antimicrobianos en la institución, optimizando los tratamientos y disminuyendo el daño colateral.
Agradecimientos
A María Virginia Villegas, infectóloga, por la revisión del manuscrito y su valiosa contribución, así como a Carlos Pérez, Jorge Cortés y Aura Lucía Leal, por sus enseñanzas en el tema de resistencia bacteriana; al grupo de bacteriólogas del área de microbiología del Hospital Departamental de Villavicencio y a la gerencia, por el apoyo en el desarrollo de este trabajo.
Declaración de posibles conflictos de interés
N. Pérez ha sido conferencista y ha participado en eventos patrocinados por Astra Zeneca, Wyeth, Pfizer, Roche, Merck Sharp & Dohme, Baxter, Jannsen- Cilag, Abbott, Hospira, UCI Pharma, Bristol Myers Squibb, Biomerieux y Rochem Biocare. N.
Pavas no declara posibles conflictos de interés. E. I.
Rodríguez ha participado en eventos patrocinados por Biomerieux y Rochem Biocare.
Correspondencia: Norton Pérez, Km 1 Vía Acacias - Anillo Vial.
Facultad de Medicina, Villavicencio, Colombia. Teléfono y fax: (5786) 682-9580. Dirección electrónica: naperez2000@hotmail.com
Referencias
1. Organización Mundial de la Salud. Estrategia mundial de la OMS para contener la resistencia a los antimicrobianos. Ginebra: Organización Mundial de la Salud; 2001. p. 99. [ Links ]
2. Villegas MV, Kattan JN, Quinteros MG, Casellas JM. Prevalence of extended-spectrum beta-lactamases in South America. Clin Microbiol Infect. 2008;14:154-8. [ Links ]
3. Tafur JD, Torres JA, Villegas MV. Mecanismos de resistencia a los antibióticos en bacterias Gram negativas. Infectio. 2008;12:217-26. [ Links ]
4. Máttar S, Martínez P. Emergencia de la resistencia antibiótica debida a las beta-lactamasas de espectro extendido (BLEE): detección, impacto clínico y epidemiología. Infectio. 2007;11:23-35. [ Links ]
5. Kang CI, Kim SH, Park WB, Lee KD, Hong-Bin. Bloodstream infections due to extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae: Risk factors for mortality and treatment outcome, with special emphasis on antimicrobial therapy. Antimicrob Agents Chemother. 2004;48:4574-81. [ Links ]
6. Kang CI, Chung DR, Ko KS, Peck KR, Song JH. Risk factors for mortality and impact of broad-spectrum cephalosporin resistance on outcome in bacteraemic intra-abdominal infections caused by Gram-negative bacilli. Scand J Infect Dis. 2011;43:202-8. [ Links ]
7. Courvalin P. Interpretative reading of antimicrobial susceptibility test. ASM News. 1992;58:368-75. [ Links ]
8. Livermore DM, Winstanley TG, Shannon KP. Interpretative reading: Recognizing the unusual and inferring resistance mechanisms from resistance phenotypes. J Antimicrob Chemother. 2001;48:87-102. [ Links ]
9. Paterson DL, Bonomo RA. Extended-spectrum beta-lactamases: A clinical update. Clin Microbiol Rev. 2005;18:657-86. [ Links ]
10. Navon-Venezia S, Ben-Ami R, Schwaber MJ, Leavitt A, Schwartz D, Carmeli Y. Protocol for the accelerated detection of extendedspectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae strains from blood cultures. Eur J Clin Microbiol Infect Dis. 2004;23:200-2. [ Links ]
11. Linscott AJ, Brown WJ. Evaluation of four commercially available extended-spectrum beta-lactamase phenotypic confirmation tests. J Clin Microbiol. 2005;43:1081-5. [ Links ]
12. Louie JP, Bell LM. Appropriate use of antibiotics for common infections in an era of increasing resistance. Emerg Med Clin North Am. 2002;20:69-91. [ Links ]
13. Ramos PJM, Espinal-Marín PA, Bustos Á, Mattar-Velilla S. Prevalencia de Klebsiella pneumoniae y Escherichia coli productoras de beta-lactamasas de espectro extendido (BLEE), en el Hospital San Jerónimo de Montería. MedUNAB. 2005;8:15-22. [ Links ]
14. Villegas MV, Correa A, Pérez F, Miranda MC, Zuluaga T, Quinn JP. Prevalence and characterization of extended-spectrum beta-lactamases in Klebsiella pneumoniae and Escherichia coli isolates from Colombian hospitals. Diagn Microbiol Infect Dis. 2004;49:217-22. [ Links ]
15. Suárez CJ, Lolans K, Villegas MV, Quinn JP. Mechanisms of resistance to beta-lactamasas in some common Gram-negative bacteria causing nosocomial infections. Expert Rev Anti Infect Ther. 2005;3:915- 22. [ Links ]
16. Miranda MC, Pérez F, Zuluaga T, Olivera Mdel R, Correa A, Reyes SL, Villegas MV; Grupo de Resistencia Bacteriana Nosocomial de Colombia. Antimicrobial resistance in Gram negative bacteria isolated from intensive care units of Colombian hospitals, WHONET 2003, 2004 and 2005. Biomédica. 2006;26:424-33. [ Links ]
17. Leal AL, Eslava-Schmalbach J, Álvarez C, Buitrago G, Méndez M. Endemic tendencies and bacterial resistance markers in third-level hospitals in Bogotá, Colombia. Rev Salud Pública 2006;8(Suppl.1):59-70. [ Links ]
18. Gaitán CS, Espinal MP. Molecular characterization of extendedspectrum ss-lactamases-producing Escherichia coli and Klebsiella pneumoniae in hospitals of the Caribean Region, Colombia. Rev Chilena Infectol. 2009;26:239-46. [ Links ]
19. Espinal PA, Mantilla JR, Saavedra CH, Leal AL, Alpuche C, Valenzuela EM. Molecular epidemiology of nosocomial infection by extendedspectrum beta-lactamases-producing Klebsiella pneumoniae. Biomédica 2004;24:252-61. [ Links ]
20. Cifuentes Y, Ruiz AI, Leal AL, Muñoz LC, Herrera MT, Jiménez LM. Microbiological profiling of isolates from the neonatal unit of a third-level hospital in Bogotá, Colombia. Rev Salud Pública (Bogotá). 2005;7:191-200. [ Links ]
21. Pérez N, Pavas N, Molina N, Rodríguez EI. Resistencia a los antimicrobianos de las enterobacterias en un hospital de la Orinoquía Colombiana. Acta Colombiana de Cuidado Intensivo. 2008;8:67-74. [ Links ]
22. Sánchez L, Ríos R, Mattar S. Detección de beta-lactamasas de espectro extendido en Escherichia coli y Klebsiella pneumoniae aislados en una clínica de Villavicencio, Colombia. Infectio. 2008;12:193- 200. [ Links ]
23. Paterson DL, Rossi F, Baquero F, Hsueh PR, Woods GL, Satishchandran V, Snyder TA, Harvey CM, Teppler H, Dinubile MJ, Chow JW. In vitro susceptibilities of aerobic and facultative Gram-negative bacilli isolated from patients with intra-abdominal infections worldwide: The 2003 Study for Monitoring Antimicrobial Resistance Trends (SMART). J Antimicrob Chemother. 2005;55:965-73. [ Links ]
24. Villegas MV, Correa A, Perez F, Zuluaga T, Radice M, Gutkind G, et al; Colombian Nosocomial Resistance Study Group. CTX-M-12 betalactamase in a Klebsiella pneumoniae clinical isolate in Colombia. Antimicrob Agents Chemother. 2004;48:629-31. [ Links ]
25. Rossi F, Baquero F, Hsueh PR, Paterson DL, Bochicchio GV, Snyder TA, et al. In vitro susceptibilities of aerobic and facultatively anaerobic Gram-negative bacilli isolated from patients with intra-abdominal infections worldwide: 2004 results from SMART (Study for Monitoring Antimicrobial Resistance Trends). J Antimicrob Chemother. 2006;58:205-10. [ Links ]
26. Hawser SP, Bouchillon SK, Hoban DJ, Badal RE, Hsueh PR, Paterson DL. Emergence of high levels of extended-spectrum-betalactamase- producing Gram-negative bacilli in the Asia-Pacific region: Data from the Study for Monitoring Antimicrobial Resistance Trends (SMART) program, 2007. Antimicrob Agents Chemother. 2009;53:3280-4. [ Links ]
27. Hawser SP, Bouchillon SK, Hoban DJ, Badal RE. In vitro susceptibilities of aerobic and facultative anaerobic Gram-negative bacilli from patients with intra-abdominal infections worldwide from 2005-2007: Results from the SMART study. Int J Antimicrob Agents. 2009;34:585-8. [ Links ]
28. Pérez N. Política de antibióticos en la UCI. En: Pérez N, editor. Manual de guías y algoritmos de manejo antibiótico en el paciente crítico. Bogotá: Distribuna; 2007. p. 9-30. [ Links ]
29. Pérez N. Políticas institucionales para el uso apropiado de antibióticos. En: Guías de manejo del Hospital Departamental de Villavicencio. Villavicencio: Hospital Departamental de Villavicencio E.S.E.; 2007. p. 9. [ Links ]
30. MicroScan. Manual de procedimiento para Gram negativo deshidratado. West Sacramento, CA: Siemens Healthcare Diagnostics Inc; 2008. [ Links ]
31. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; 16th informational supplement. CLSI/NCCLS M100-S16: Clinical and Laboratory Standards Institute; 2006. [ Links ]
32. Rankin ID. Sistemas comerciales. In: Coyle MB, editor. Manual de pruebas de susceptibilidad antimicrobiana. Seattle, WA: Organización Panamericana de la Salud (PAHO); 2005. p. 93-100. [ Links ]
33. O´Brien T, Stelling J. Whonet 5,5. In: WHO collaborating Centre for the Surveillance of Antibiotic Resistance. Boston, MA: Organización Mundial de la Salud; 2008. [ Links ]
34. Oliveros H. EPISET versión 1,1. En: Asociación Colombiana de Medicina Critica y Cuidado Intensivo. Bogotá, Colombia; 2007. [ Links ]
35. Ministerio de Salud. Por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud. Resolución 8430 Parágrafo primero Artículo 16. Bogotá: Imprenta Nacional de la Republica de Colombia; 1993. p. 17. [ Links ]
36. Boletín GREBO. Información resistencia bacteriana GREBO año 2009. Bogotá: Grupo para el control de la resistencia bacteriana de Bogotá, [Serial en línea.]. 2009:12. Fecha de consulta: 12 de agosto de 2011. Disponible en: www.grebo.org. [ Links ]
37. Lee NY, Huang WH, Tsui KC, Hsueh PR, Ko WC. Carbapenem therapy for bacteremia due to extended-spectrum beta-lactamase-producing Escherichia coli or Klebsiella pneumoniae. Diagn Microbiol Infect Dis. 2011;70:150-3. [ Links ]
38. Winokur PL, Canton R, Casellas JM, Legakis N. Variations in the prevalence of strains expressing an extended-spectrum betalactamase phenotype and characterization of isolates from Europe, the Americas, and the Western Pacific region. Clin Infect Dis. 2001;32(Suppl.2):S94-103. [ Links ]
39. Ruiz SJ, Montealegre MC, Ruiz-Garbajosa P, Correa A, Briceño DF, Martínez E, et al. First characterization of CTX-M-15-producing Escherichia coli ST131 and ST405 clones causing community-onset infections in South America. J Clin Microbiol. 2011;49:1993-6. [ Links ]
40. Gales AC, Jones RN, Gordon KA, Sader HS, Wilke WW, Beach ML, et al. Activity and spectrum of 22 antimicrobial agents tested against urinary tract infection pathogens in hospitalized patients in Latin America: Report from the second year of the SENTRY antimicrobial surveillance program (1998). J Antimicrob Chemother. 2000;45:295- 303. [ Links ]
41. Peirano G, Costello M, Pitout JD. Molecular characteristics of extended- spectrum beta-lactamase-producing Escherichia coli from the Chicago area: High prevalence of ST131 producing CTX-M-15 in community hospitals. Int J Antimicrob Agents. 2011;36:19-23. [ Links ]
42. Martin O, Valverde A, Morosini MI, Rodríguez-Domínguez M, Rodríguez- Banos M, Coque TM, et al. Population analysis and epidemiological features of inhibitor-resistant-TEM-beta-lactamase-producing Escherichia coli isolates from both community and hospital settings in Madrid, Spain. J Clin Microbiol. 2011;48:2368-72. [ Links ]
43. Rodríguez-Bano J, Alcala JC, Cisneros JM, Grill F, Oliver A, Horcajada JP, et al. Community infections caused by extended-spectrum beta-lactamase-producing Escherichia coli. Arch Intern Med. 2008;168:1897-902. [ Links ]
44. Pallecchi L, Bartoloni A, Fiorelli C, Mantella A, Di Maggio T, Gamboa H, et al. Rapid dissemination and diversity of CTX-M extendedspectrum beta-lactamase genes in commensal Escherichia coli isolates from healthy children from low-resource settings in Latin America. Antimicrob Agents Chemother. 2007;51:2720-5. [ Links ]
45. Johnson MT, Reichley R, Hoppe-Bauer J, Dunne WM, Micek S, Kollef M. Impact of previous antibiotic therapy on outcome of Gramnegative severe sepsis. Crit Care Med. 2011;39:1859-65. [ Links ]
46. Rodríguez-Bano J, Picon E, Gijon P, Hernández JR, Ruiz M, Peña C, et al. Community-onset bacteremia due to extended-spectrum betalactamase- producing Escherichia coli: Risk factors and prognosis. Clin Infect Dis. 2011;50:40-8. [ Links ]
47. Solomkin JS, Mazuski JE, Bradley JS, Rodvold KA, Goldstein EJC, Baron EJ, et al. Diagnosis and management of complicated intraabdominal infection in adults and children: Guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Clin Infect Dis. 2010;50:133-64. [ Links ]
48. Espinar MJ, Rocha R, Ribeiro M, Goncalves A, Pina-Vaz C. Extended- spectrum beta-lactamases of Escherichia coli and Klebsiella pneumoniae screened by the VITEK 2 system. J Med Microbiol. 2011;60:756-60. [ Links ]
49. Trevino M, Martínez-Lamas L, Romero-Jung P, Varón C, Moldes L, García-Riestra C, et al. Comparative assessment of the Vitek 2 and Phoenix systems for detection of extended-spectrum beta-lactamases. Enferm Infecc Microbiol Clin. 2009;27:566-70. [ Links ]
50. Chen HM, Wu JJ, Tsai PF, Wann JY, Yan JJ. Evaluation of the capability of the VITEK 2 system to detect extended-spectrum beta-lactamase- producing Escherichia coli and Klebsiella pneumoniae isolates, in particular with the coproduction of AmpC enzymes. Eur J Clin Microbiol Infect Dis. 2009;28:871-4. [ Links ]
51. Sorlórzano A, Gutiérrez J, Piedrola G, Soto MJ. Acceptable performance of VITEK 2 system to detect extended-spectrum beta-lactamases in clinical isolates of Escherichia coli: A comparative study of phenotypic commercial methods and NCCLS guidelines. Diagn Microbiol Infect Dis. 2005;51:191-3. [ Links ]
52. Leverstein-van Hall MA, Fluit AC, Paauw A, Box AT, Brisse S, Verhoef J. Evaluation of the Etest ESBL and the BD Phoenix, VITEK 1, and VITEK 2 automated instruments for detection of extended-spectrum beta-lactamases in multiresistant Escherichia coli and Klebsiella spp. J Clin Microbiol. 2002;40:3703-11. [ Links ]
53. Farber J, Moder KA, Layer F, Tammer I, Konig W, Konig B. Extendedspectrum Beta-lactamase detection with different panels for automated susceptibility testing and with a chromogenic medium. J Clin Microbiol. 2008;46:3721-7. [ Links ]
54. Thomson KS, Cornish NE, Hong SG, Hemrick K, Herdt C, Moland ES. Comparison of Phoenix and VITEK 2 extended-spectrum-beta-lactamase detection tests for analysis of Escherichia coli and Klebsiella isolates with well-characterized beta-lactamases. J Clin Microbiol. 2007;45:2380-4. [ Links ]
55. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; twentieth informational supplement. M100-S20. 20th ed. Wayne, PA: CLSI; 2010. [ Links ]














