Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Salud Pública
Print version ISSN 0124-0064
Rev. salud pública vol.18 no.3 Bogotá May/June 2016
https://doi.org/10.15446/rsap.v18n3.46923
Doi: http://dx.doi.org/10.15446/rsap.v18n3.46923
Artículos Investigación
Detección de proteínas transgénicas en harinas de maíz comercializadas en Bogotá, Colombia
Detection of transgenic proteins in maize flour marketed in Bogotá, Colombia
Lizeth Y. Tabima-Cubillos1, Alejandro Chaparro-Giraldo2 y Martha L. Trujillo-Güiza3
1 Departamento de Biología. Universidad Nacional de Colombia. Bogotá. lytabimac@unal.edu.co
2 Departamento de Biología e Instituto de Genética. Universidad Nacional de Colombia. Bogotá. achaparrog@unal.edu.co
3 Facultad de Medicina. Universidad Antonio Nariño. Bogotá, Colombia. mmalitg@gmail.com
Recibido 27 Octubre 2015/Enviado para Modificación 16 Enero 2016/Aceptado 22 Febrero 2016
RESUMEN
Objetivo Detectar la presencia o ausencia de proteínas transgénicas derivadas de cultivos genéticamente modificados (GM) en harina de maíz comercializadas en Bogotá D.C., Colombia.
Métodos Se evaluaron 11 protocolos de extracción de proteína total en 17 harinas pre-cocidas, dos no cocidas y tres controles positivos. Posteriormente, se determinó la presencia de 7 proteínas transgénicas (CP4EPSPS, Cry1Ab, Cry1Ac, Cry1F, Cry2A, Cry34Ab1 y Cry3Bb1) utilizando kits de ELISA comerciales.
Resultados Se determinó que el mejor protocolo de extracción de proteína total fue el buffer con Tritón X-100, con el que se obtienen concentraciones de proteína mayores a 0,5 mg/g de harina y no genera interferencia con la técnica de ELISA. Se detectaron cuatro proteínas transgénicas: CP4EPSPS, Cry1F, Cry1Ab y Cry34Ab1 en harinas pre-cocidas y sin pre-cocción, con porcentajes que varían entre el 20 y 100 %.
Conclusión Siete de las 19 harinas de maíz evaluadas contienen trazas de proteínas transgénicas (B2,B8,A3,O3,O1,C1 y C2), que confieren resistencia a lepidópteros o coleópteros y tolerancia al herbicida glifosato (CP4EPSPS, Cry1Ab, Cry1F, Cry34Ab1 y Cry3Bb1), todos los eventos detectados están aprobados para el consumo humano en Colombia según el Ministerio de Salud y Protección Social.
Palabras Clave: Maíz, ingeniería genética, proteínas, ELISA (fuente: DeCS, BIREME).
ABSTRACT
Objective To detect the presence or absence of transgenic proteins derived from GM crops in maize flour marketed in Bogota D.C., Colombia.
Methods 11 extraction protocols for total protein were evaluated in 17 precooked flour, two uncooked and three positive controls. Subsequently, the presence of 7 transgenic proteins (CP4-EPSPS, Cry1Ab, Cry1Ac, Cry1F, Cry2A, Cry34Ab1 and Cry3Bb1) using commercial ELISA kits was determined.
Results It was determined that the best protocol for total protein extraction was buffer with Triton X-100, which allowed obtaining protein concentrations greater than 0.5 mg per gram of flour and does not generate interference with the ELISA technique. Four transgenic proteins were detected: CP4EPSPS, Cry1F, Cry1Ab and Cry34Ab1 in precooked and uncooked flour with percentages varying between 20 and 100 %.
Conclusion Seven of the 19 maize flours contain traces of transgenic protein (B2,B8,A3,O3,O1,C1 and C2) that provide resistance to lepidopterans and coleopterans, and tolerance to glyphosate herbicide, (CP4EPSPS- Cry1Ab, Cry1F, Cry34Ab1 and Cry3Bb1). All detected events are approved for human consumption in Colombia, according to the Ministry of Health and Social Protection.
Key Words: Maize, genetic engineering, proteins, ELISA (source: MeSH, NLM).
El maíz (Zea mays) es el cereal de mayor importancia agrícola en el mundo, en cuanto a volumen de producción, entre los años 2013/2014 se produjeron aproximadamente 1 010 millones de toneladas, cifra que supera las de otros cereales como trigo y arroz (1). En Colombia, durante el año 2013, el cultivo de maíz ocupó aproximadamente 479 mil hectáreas, que generaron una producción superior a las 1,6 millones de toneladas al año (2). Con respecto al maíz genéticamente modificado (GM), en el año 2013 se sembraron en el mundo 51 millones de hectáreas, mientras que en Colombia se sembraron 75 mil hectáreas (3,4). El consumo del cereal en Colombia supera los cinco millones de toneladas y ya que su producción es deficitaria, se hace necesaria su importación. Durante el año 2013, se importaron 3,5 millones de toneladas de maíz, provenientes de Estados Unidos, Brasil y Argentina, este maíz posiblemente contenga semillas GM, por provenir de países que utilizan en gran medida este tipo de transferencia de tecnología (2).
Existen muchos productos derivados total o parcialmente del maíz, y entre ellos la harina es uno de los más consumidos. La harina se produce directamente del grano, y puede contener algunas trazas de proteínas codificadas por genes introducidos mediante técnicas de ingeniería genética (proteínas transgénicas). Algunos autores han sugerido que la presencia de trazas de proteínas transgénicas pueden causar algún impacto en la salud humana (5,6), sin embargo, otros autores, desde otra perspectiva consideran que el uso de cultivos GM puede incrementar los niveles de producción, reducir el uso de agroquímicos e insecticidas y mejorar la calidad nutricional de alimentos, generando productos más nutritivos (7,19).
En Colombia se estableció la Ley 740 de 2002, por medio de la cual se aprueba el "Protocolo de Cartagena sobre Seguridad de la Biotecnología del Convenio sobre la Diversidad Biológica", que tiene como objetivo garantizar la protección en la utilización de organismos vivos modificados (OVM), que puedan tener efectos adversos para la conservación y la utilización sostenible de la diversidad biológica, como también riesgos para la salud humana. Por otro lado, se estableció el Laboratorio Central Interinstitucional de Detección y Monitoreo de Organismos Genéticamente Modificados (OGM), en el que se determina la ausencia o presencia de eventos GM en granos. En este laboratorio se utiliza la identificación de DNA de los eventos GM a través de la amplificación de secuencias específicas mediante la reacción en cadena de la polimerasa (PCR). Sin embargo, la detección de un OGM debe incluir además de la determinación del DNA insertado, la presencia de la proteína expresada (8).
En Colombia, el etiquetado de alimentos OGM está restringido al cumplimiento de ciertas condiciones, por tal razón, las etiquetas de las harinas de maíz comercializadas en el país, no presentan esta información. La Resolución 4254 de 2011 del Ministerio de Salud y Protección Social, indica que solo deberá etiquetarse cuando: a) no haya equivalencia sustancial entre la planta con el evento GM y la que no lo tiene; b) cambie la forma de preparación o cocción del alimento frente al alimento sin el evento GM insertado; c) se exprese un alérgeno que los consumidores no esperan, o se presente diferencia en las propiedades organolépticas del alimento derivado de un OGM. Teniendo en cuenta que no existe en el país información sobre la ausencia o presencia de proteínas derivadas de cultivos GM, el objetivo de este trabajo fue realizar la detección de proteínas transgénicas en harinas de maíz de consumo humano comercializadas en Bogotá D.C., Colombia, y establecer un protocolo para la determinación de proteínas GM en harinas de maíz.
MATERIALES Y MÉTODOS
Muestras
Las muestras consistieron en harinas de maíz, para consumo humano, que se comercializaron en almacenes de cadena de Bogotá, D.C. en el año 2013. Se hizo la selección teniendo en cuenta el tipo de grano, el grado de procesamiento y su composición. Se evaluaron aquellas harinas que en su contenido presentaron solo maíz o trazas de avena, trigo o soya, descartando las que contenían mezclas de otro tipo de harina y las féculas por su alto contenido de almidón. Las harinas fueron las harinas crudas de grano partido (cuchuco de maíz) y harinas pre-cocidas extrafinas (Tabla 1). El muestreo se realizó por triplicado verificando que las harinas no pertenecieran al mismo lote de producción.
Extracción de proteínas
Se compararon diferentes protocolos de extracción de proteína total para seleccionar el método más adecuado, con el que se pueda obtener gran cantidad de proteína, sin generar interferencia con la prueba inmunológica para la detección de OGM. Para esto, se seleccionó una harina de maíz de cada tipo, una blanca, una amarilla y una mezcla de harina amarilla y blanca (B8, A5 y O2). En cada caso, se mezclaron 200 mg de cada una de las harinas con 1,5 mL de cada buffer así:
- Extracción con buffer carbonato (T1): se homogenizó la mezcla (con buffer carbonato 50 mM con 0,15 mM de NaCl pH 9,6), y agitación durante 60 minutos a 1000 rpm. Los extractos se centrifugaron a 13 000 rpm por 15 minutos, los sobrenadantes fueron almacenados a -20 °C (9).
- Extracción alcalina (T2): se utilizó agua destilada pH 12 para homogenizar la muestra, manteniendo una relación final harina/solución de extracción de 1:10 p/v. Después la mezcla se centrifugó a 13 000 rpm durante 20 minutos y el sobrenadante se conservó congelado a -20°C (11).
- Extracción con buffer fosfato de sodio (PBS) - Tween20: la muestra se homogenizó en buffer fosfato de sodio (NaCl 138 mM, KCl 3 mM, Na2HPO4 8,1 mM, KH2PO4 1,5 mM, pH 7,4) y Tween20 al 5%, la mezcla se agitó durante 60 minutos (T3), los extractos se centrifugaron a 13 000 rpm por 15 minutos y los sobrenadantes fueron almacenados a -20 °C. Se probaron para esta extracción, dos tiempos de sonicación de la muestra: durante 20 minutos (T8) y 30 minutos (T11) (10).
- Extracción con buffer fosfato de sodio (PBS) - sodio dodecil sulfato (SDS) (T4): se homogenizo la muestra en buffer fosfato de sodio (NaCl 138 mM, KCl 3 mM, Na2HPO4 8,1 mM, KH2PO4 1,5 mM, pH 7,4) y SDS al 1 %, durante 90 minutos y posteriormente se centrifugaron los extractos a 13 000 rpm por 15 minutos; los sobrenadantes fueron almacenados a -20 °C (10).
- Extracción con buffer Tritón X-100 (T5): se homogenizo la muestra con buffer (20 mM Tris-HCl, pH 7,5; 137 mM NaCl, 1 mM MgCl2, 1 mMCaCl2, 10 % glicerol) y Tritón X-100 al 1 %, la mezcla se agitó durante 90 minutos y se mantuvo en hielo 30 minutos, luego se centrifugó para eliminar sustancias insolubles (13 000 rpm por 15min) y se conservó el sobrenadante -20 °C.
- Extracción con buffer carbonato y sonicación: se utilizó buffer carbonato 50 Mm con 0,15 M de NaCl para homogenizar la muestra, se agitó durante 60 minutos y se sonicó durante 20 minutos (T6), este mismo procedimiento se llevo a cabo, sonicando por 30 minutos (T9). Los extractos se centrifugaron a 13 000 rpm por 15 minutos y los sobrenadantes se almacenaron a -20 °C.
- Extracción con NaCl 1 M y sonicación: se homogenizó la muestra con NaCl 1M, se agitó la mezcla durante 60 minutos y se le aplicó sonicación durante 20 minutos (T7). Este procedimiento también se probó con 30 minutos de sonicación (T10). Los extractos se centrifugaron a 13 000 rpm por 15 minutos y los sobrenadantes fueron almacenados a -20°C.
Cuantificación de proteína total
A partir de los extractos se realizó la cuantificación de proteína total, (OGM y no OGM) mediante espectrofotometría utilizando el estuche "110306 Proteínas (según el método de Bradford)" de cuantificación de proteína Merck®. Los procedimientos se realizaron por triplicado con cada harina, siguiendo las instrucciones del fabricante.
Detección de proteínas transgénicas
La presencia de proteína derivada de cultivos GM en harinas de maíz se determinó mediante la técnica de ELISA, utilizando estuches comerciales tipo "sándwich" fabricados por Agdia®. Las determinaciones para detectar la presencia de cada proteína transgénica, se hicieron por triplicado en los extractos de harina provenientes del protocolo previamente seleccionado. Los controles positivos utilizados en las determinaciones fueron grano de maíz GM certificado por el INVIMA y autorizado en Colombia para consumo humano, NK603, NK603+MON810 y NK603+MON89034, además del control interno que incluye cada estuche de ELISA. Como control negativo se utilizaron semillas de maíz no-GM, variedad local denominada Chicalá, obtenida en el mercado local del municipio de Cachipay (Cundinamarca). Los granos enteros fueron sometidos a proceso de pre-cocción similar al que se lleva a cabo en la preparación de las harinas de maíz pre-cocidas, presión 35 libras por pulgada cuadrada (PSI) y temperatura de 100°C durante 30 minutos (12).
Para la detección de proteínas derivadas de eventos GM se utilizaron los siguientes estuches de ELISA Agdia® (evento): Cry1Ab/Cry1Ac (MON810 y Bt-11), Bt-Cry1F (TC1507), Bt-Cry2A (MON89034), Bt-Cry34Ab1 (DAS-59122-7), Bt-Cry3Bb1 (MON863 y MON88017), Bt-Cry3Bb1/Cry1Ab (MON810, MON863 y MON88017), y Roundup Ready (múltiples eventos).
Análisis estadístico
El diseño experimental utilizó bloques completos al azar, con tres repeticiones por tratamiento. Los resultados de los protocolos de extracción fueron sometidos a pruebas de Bartlett y Shapiro Wilk para determinar homogeneidad de varianzas y normalidad. Se hizo el análisis de varianza y se compararon las medias mediante la prueba de Tukey, considerando el 95 % de confiabilidad, mediante el programa estadístico SPSS.
Para el análisis de los resultados de la técnica de ELISA de tipo cualitativo, se calculó el valor del punto de corte tomando en cuenta la suma de cuatro esviaciones estándar del promedio de las densidades ópticas de las muestras aparentemente negativas, es decir 0,06 + (4 x 0,03) lo que determina que las muestras serán positivas si presentan valores superiores a 0,2.
RESULTADOS
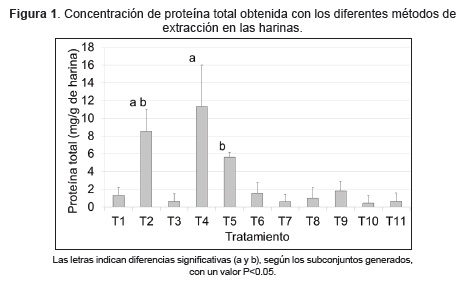
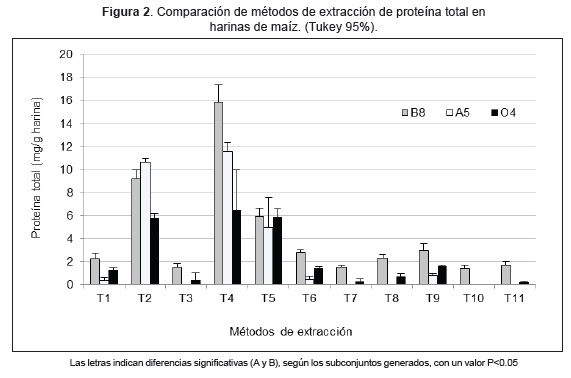
Tratando de establecer el mejor protocolo de extracción de proteína total, se obtuvieron variaciones de la concentración en las muestras analizadas. La extracción con buffer carbonato, produjo una concentración de proteína que osciló entre 0,3 y 2,3 mg/g de harina, mientras que con el buffer PBS no se detectó proteína en la harina A5 pero si en las harinas B8 y O4. Con la extracción alcalina se observaron valores entre 5,7 y 10,7 mg/g de harina y con el buffer que contenía Tritón X-100, los valores obtenidos estuvieron entre 4,8 y 6,0 mg/g de proteína. En los casos en que se incluyó sonicación luego de la extracción, no se logró detectar proteína en la harina A5 pero si en las harinas B8 y O4 (valores entre 0,1 y 3,0 mg/g de harina). Las concentraciones más altas de proteína se obtuvieron con el buffer fosfato sódico más SDS al 1% (Figura 1).
Con la prueba de comparación de medias de Tukey, se detectaron diferencias significativas (p<0,05), entre el método de extracción (T4: buffer fosfato sódico con SDS al 1 %) y los demás métodos, a excepción de la extracción alcalina (T2), que no presentó diferencia significativa (p=0,4). También se logró determinar que la extracción alcalina (T2) y el buffer PBS con Tritón X-100 al 1 % (T5) no presentan diferencias significativas (p=0,4), pero si frente a los otros métodos utilizados (Figura 2).
Teniendo en cuenta el análisis estadístico, los mejores métodos de extracción fueron el buffer fosfato sódico con SDS al 1 %, la extracción alcalina y el buffer con Tritón X-100 al 1 %, correspondientes a los tratamientos T2, T4 y T5 respectivamente. Sin embargo, al llevar a cabo las pruebas de ELISA en los controles positivos, (muestras de grano transgénico NK603, MON810+NK603 y MON89034+NK603) utilizando el estuche de detección de la proteína transgénica CP4EPSPS, los protocolos T4 y T2 generaron interferencia. Esto puede ser debido a la presencia de SDS en concentración del 1 % y al elevado pH (extracción alcalina, pH 12) respectivamente. La interferencia se hizo evidente al observar valores negativos en las muestras evaluadas. Por el contrario, con el buffer con Tritón X-100 al 1 % (T5), se alcanzaron valores de absorbancia superiores a 0,2, que indican detección positiva de la proteína transgénica. Teniendo en cuenta estos resultados, se seleccionó el tratamiento 5 (T5: buffer con Tritón X-100 al 1%), para las siguientes extracciones de proteína total, en las muestras de harina a evaluar presencia de proteínas genéticamente modificadas.
Detección de proteína transgénica
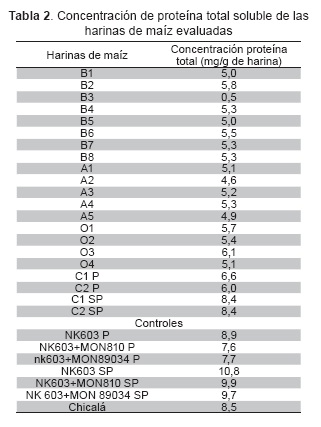
Se analizaron 27 muestras de harina de maíz (19 harinas comerciales, 3 controles positivos y un control negativo, estos últimos con y sin pre-cocción), haciendo en cada una la extracción y cuantificación de proteína soluble. Las concentraciones de proteína total variaron entre 4 y 11 mg/g de harina, destacándose que las concentraciones más altas de proteína fueron obtenidas con la harina proveniente de los granos de maíz entero o partido, es decir, los controles positivos (transgénico), el maíz variedad Chicalá (control negativo) y el cuchuco de maíz con y sin pre-cocción (Tabla 2).
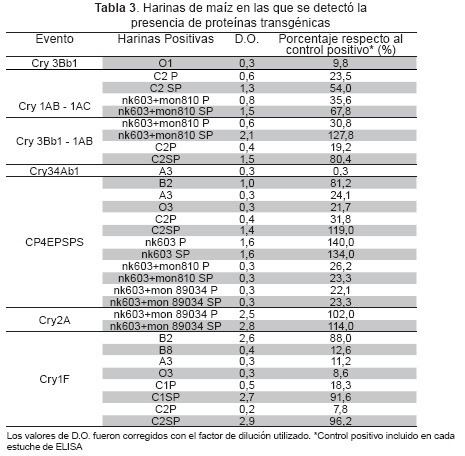
En la Tabla 3 se presentan los resultados de la detección de proteínas transgénicas en las harinas de maíz evaluadas. Las muestras B2, A3, O3 y C2 presentaron valores de densidad óptica (D.O.) superiores a 0,2 para la proteína CP4EPSPS. En cuanto a la proteína Cry1F fue detectada en las muestras B2, B8, A3, O3, C1 y C2, presentando la harina B2 valores de D.O. de 2,6, C1SP 2,7 y C2SP 2,9 (Tabla 3).
La harina C2 contiene la proteína Cry1AB en un valor similar al que presenta el grano de maíz transgénico NK603+MON810. Para la proteína Cry34Ab1 se realizó ELISA de tipo cuantitativo. Se detectó presencia en la harina A3 en una concentración de 0,1 pg/mg. En las 19 harinas comerciales evaluadas, no se detectó la presencia del evento de transformación Cry2A (Tabla 3).
DISCUSIÓN
Para establecer el protocolo de detección de proteínas transgénicas a partir de harinas de maíz, se requería la selección de un método de extracción adecuado. Con el protocolo T4 se obtuvieron concentraciones de proteína total soluble similares a las reportadas por el estudio de Margarit (13), para alimentos procesados (polenta pre-cocida y hojuelas de maíz) mediante el estuche comercial de Envirologix® (buffer PBS), obteniendo valores entre 0,2 y 4,9 mg/g de muestra. En este mismo trabajo, la extracción con agua alcalina (pH entre 9 y 12), se hace para proteína de harinas de arroz integral, logrando en condiciones de pH12 como la concentración más alta, 0,1 mg/g de harina (11). Mientras que en este trabajo se obtuvo una concentración mayor de proteína total (8,5 mg/g de harina), posiblemente debido que la muestra utilizada fue maíz.
Con respecto, al efecto de la sonicación en la extracción de proteínas a partir de harinas de maíz, el trabajo de Oszvald (10) reporta una recuperación de hasta 90 % de las proteínas contenidas en la harina de arroz, usando un protocolo de dos pasos, primero buffer fosfato sódico y 0,5 % de SDS con agitación por 30 minutos y posteriormente sonicación con amplitud del 50 % por 30 segundos. En el presente estudio, cuando se aplicó sonicación durante 20 y 30 minutos con diferentes buffers, se recuperó apenas el 50 % de la proteína registrada en la etiqueta del producto analizado. La efectividad del protocolo de extracción del buffer con Tritón X-100, puede deberse a que el Tritón X-100 es un detergente no desnaturalizante, que no penetra las proteínas solubles, y no altera interacciones ni estructuras (14). Por el contrario, detergentes como el SDS actúan rompiendo enlaces no covalentes en las proteínas, desnaturalizándolas, provocando que las moléculas proteicas pierdan su conformación nativa (14). El método de extracción con Tritón X-100 ha sido ampliamente utilizado para la extracción de proteínas a partir de tejido animal y en algunos casos tejido vegetal, pero se ha empleado poco en alimentos procesados, como en este estudio con harinas de maíz (14).
En los casos en que no se detecta la presencia de un evento específico de transformación en las 19 harinas de maíz evaluadas, como sucede con el evento Cry2A (Tabla 3), pueden considerarse dos posibilidades, una es que posiblemente el maíz utilizado en la preparación de la harina efectivamente no contenga granos transgénicos, o que las proteínas transgénicas se hayan degradado durante en el proceso de pre-cocción, ya que el calentamiento y otros tratamientos a los que son sometidos los alimentos en la industria, cambian la estructura terciaria de las proteínas Cry, y por lo tanto los epítopes reconocidos por los anticuerpos (9), impidiendo que sean reconocidos mediante técnicas inmunológicas. Resultados similares presenta el trabajo De Luis (9), en el que buscaban evaluar el efecto de diferentes procesos a los que se someten los alimentos, como nixtamalización, cocinar a la plancha y fritura.
Encontraron que la proteína Cry1Ab se desnaturaliza con esos procesos y no es posible detectarla por la técnica de ELISA. Sin embargo en un estudio anterior de Margarit (13), se detectó proteína Cry1Ab en polenta pre-cocida utilizando un estuche comercial de ELISA (93,9 ng Bt/g comida); esto posiblemente sea debido a que partieron de una concentración mayor de proteína, o a que el proceso de pre-cocción no fue tan drástico como los realizados en el trabajo De Luis (9) (pre-cocción a 100°C, cocinar a la plancha a 250°C y freír a 190°C). En el presente trabajo, cuando el grano de maíz fue sometido a pre-cocción (temperatura y presión), la cantidad de proteína disminuyo entre 20 % y 30 % con respecto a la del maíz sin cocción. En el estudio de Orlandy (14), se utiliza la técnica de ELISA para detectar y cuantificar la proteína Cry9C en diferentes alimentos procesados; ellos reportaron que la proteína transgénica varía entre 3 y 13,5 % en pan de maíz, muffins y polenta, mientras que en alimentos como tortilla y hojuelas de maíz, la concentración de proteína Cry9C fue muy baja o no se detectó.
En el proceso de detección de la proteína CP4EPSPS, en este trabajo se encontró que la concentración de proteína transgénica de la harina C2 sin pre-cocción (C2SP), es similar a la que se presenta en el maíz NK603 (control positivo), teniendo en cuenta que según Monsanto la cantidad de proteína CP4EPSPS expresada en un grano de maíz es de 10,9 microg/mg (15).
En el presente estudio se observaron variaciones entre 7 y 100 % en harinas con y sin pre-cocción, cuando se expresaron los resultados de D.O. observada en cada muestra, como porcentaje con respecto a la D.O. del control positivo del estuche comercial. Con respecto a la presencia de la proteína Cry1F, en la harina C2SP, la densidad óptica observada es 96,2 % del control positivo del kit de ELISA, lo que sugiere una concentración similar a la del maíz transgénico, según reporte del INVIMA del nivel de expresión en el grano de maíz transgénico TC1507 de 110,9 pg/µg peso seco (16). La harina C2 contiene la proteína Cry1AB (54,0 %) en un porcentaje similar al que presenta el grano de maíz transgénico NK603+MON810 (65,8 %). Según el reporte de Monsanto, el nivel de expresión del grano de maíz MON810 es de 0,41 mg/g peso fresco (17). La proteína Cry34Ab1 detectada en la harina A3, en una concentración de 0,1 pg/mg, es un valor muy bajo, puesto que según el reporte de Monsanto, en un grano de maíz (DAS-59122-7) el nivel de expresión de esta proteína es de 49,7 ng/mg, (18).
Siete de las 19 harinas de maíz evaluadas contienen trazas de proteínas transgénicas (B2, B8, A3, O3, O1, C1 y C2) que confieren resistencia a lepidópteros o coleópteros y tolerancia al herbicida glifosato. Las proteínas transgénicas encontradas en las harinas de maíz (CP4EPSPS, Cry1Ab, Cry1F, Cry34Ab1 y Cry3Bb1) están aprobadas para el consumo humano según datos del Ministerio de Salud y Protección Social, aunque su etiquetado no es obligatorio por no presentar modificaciones en las propiedades organolépticas, nutricionales, condiciones de uso o presencia de alérgenos •
Agradecimientos: Los autores agradecen a la Vicerrectoría de Ciencia, Tecnología e Innovación, de la Universidad Antonio Nariño por la financiación del proyecto de investigación en el que se enmarca este trabajo; al Profesor Orlando Acosta, de la Facultad de Medicina de la Universidad Nacional por sus recomendaciones; al Dr. Daniel Rubio de la Dirección de Promoción y Prevención del Ministerio de Salud y Protección Social, quien facilitó el acceso a datos actualizados sobre los OGM en Colombia y los controles positivos y al Departamento de Biología de la Universidad Nacional de Colombia por su apoyo en la realización del trabajo de investigación.
Conflicto de intereses: Ninguno.
REFERENCIAS
1. WORLD-TOTAL CEREALS at a glance. En Agricultural Market Information System [Internet]. Disponible en http://statistics.amis-outlook.org/data/index.html. Consultado en octubre de 2014. [ Links ]
2. FENALCE. Indicadores cerealistas. Bogotá; 2014. [Internet]. Disponible en: http://www.fenalce.org/nueva/plantillas/arch_down_load/Ind._Cerealista_2014A.pdf. Consultado en octubre de 2014. [ Links ]
3. Asociación de biotecnología vegetal agrícola. Transgenicos en el mundo [Internet]. Agrobio. 2014. Disponible en: http://agrobio.org.co/fend/index.php?op=YXA9I2JXbDQmaW09I016UT0. Consultado en marzo de 2014. [ Links ]
4. James C. Global Status of Commercialized Biotech/GM Crops: 2013. ISAAA. 2014; 46:4-7. [ Links ]
5. Phillips T. Genetically Modified Organisms (GMOs): Transgenic Crops and Recombinant DNA Technology. Nat Educ. 2008; 1:213. [ Links ]
6. Food Safety Department. Modern food biotechnology, human health and development: an evidence-based study. 2005; p. 11-24. [ Links ]
7. Chaparro-Giraldo A. Cultivos transgénicos: entre los riesgos biológicos y beneficios ambientales y económicos. Acta Biol Colomb. 2011; 16:231-52. [ Links ]
8. Maldonado C, Álvarez E, Castellanos J. Manual de procedimientos de laboratorio para detección de organismos genéticamente modificados (OGM). Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt; 2007. [ Links ]
9. Luis R, Lavilla M, Sánchez L, Calvo M, Pérez MD. Immunochemical detection of Cry1A(b) protein in model processed foods made with transgenic maize. Eur Food Res Technol. 2009; 229(1):15-9. [ Links ]
10. Oszvald M, Tömösközi S, Larroque O, Keresztényi E, Tamás L, Békés F. Characterization of rice storage proteins by SE-HPLC and micro z-arm mixer. J Cereal Sci. 2008; 48(1):68-76. [ Links ]
11. Pinciroli M. Extracción de proteínas totales. Proteínas de arroz propiedades estructurales y funcionales. Buenos Aires: CIDCA; 2010. p. 30. [ Links ]
12. Fenalce. Producción de harinas precocidas de maíz. Plan de negocios. Bogotá; 2007 p. 69-71. [ Links ]
13. Margarit E, Reggiardo MI, Vallejos RH, Permingeat HR. Detection of BT transgenic maize in foodstuffs. Food Res Int. 2006; 39(2):250-5. [ Links ]
14. Müller-Esterl W. Bioquímica. Fundamentos para Medicina y Ciencias de la Vida. Barcelona: Reverte; 2008. [ Links ]
15. Monsanto Agricultura España. Evaluación de la seguridad del maíz Roundup Reday® ,evento NK603. Madrid; 2002; p. 13. [ Links ]
16. INVIMA. Híbridos de maíz genéticamente modificados con tecnología conjunta Herculex i (TC1507) x Roundup Ready (NK603) como alimento o materia prima para la elaboración de alimentos para consumo humano. Bogotá; 2008; p. 6. [ Links ]
17. Monsanto Agricultura España. Seguridad del maíz MON 810 (YIELDGARD® ) genéticamente protegido contra taladros. Madrid; 2001; p. 52. [ Links ]
18. Dow AgroSciences. Solicitud de Liberación Experimental al Ambiente de maíz genéticamente modificado con el evento: DAS-59122-7. Guadalajara; 2010; p. 39. [ Links ]
19. Acosta Or, Chaparro-Giraldo, A. Biocombustibles, Seguridad Alimentaria y Cultivos Transgénicos. Rev. Salud Pública (Bogotá) 2009; 11(2), 290-300. [ Links ]