Introducción
La fasciolosis es una enfermedad parasitaria de distribución mundial, causada por el trematodo Fasciola hepatica (F. hepatica) (Charlier et al., 2007; López Corrales et al., 2021), que afecta a bovinos, ovinos, caprinos y ocasionalmente al hombre. Los estadios adultos de F. hepatica se localizan en los conductos biliares de los hospedadores definitivos y requieren de caracoles Lymnaea como huéspedes intermediarios para su transmisión (Charlier et al., 2020). Las infecciones en ovejas suelen ser más severas que en vacas debido a la falta de resistencia generada en los pequeños rumiantes (Hayward, Skuce y McNeilly, 2021). La presentación clínica de la infección por F. hepatica suele ocurrir en forma aguda, con una gran cantidad de parásitos que se alojan en el hígado en un periodo corto de tiempo, causando un daño hepático grave y la muerte súbita de los ejemplares ovinos (Munita et al., 2019). La fasciolosis afecta directamente la productividad y el bienestar de las ovejas, además de ser un factor predisponente para enfermedades como la mastitis y cambios en los parámetros hemáticos (Joachim, Ali y Daugschies, 2002; Mavrogianni et al., 2014; Rokni, 2014).
Los métodos de diagnóstico de la fasciolosis como el recuento de huevos en heces, la detección de anticuerpos en suero o las pruebas de coproantígeno están dirigidos a detectar la infección por Fasciola en rumiantes in vivo (Fairweather, 2011). El método coproparasitológico, como principal método diagnóstico, es limitante ya que carece de sensibilidad, debido a que solamente diagnostica infecciones con altas cargas parasitarias (Vercruysse y Claerebout, 2001). Los ensayos inmunoabsorbentes ligados a enzimas (ELISA) mejoran la sensibilidad y la precisión de la detección de trematodos en ovinos y bovinos (Alvarez Rojas et al., 2014; Charlier et al., 2008), presentado beneficios en el diagnóstico temprano de la enfermedad en comparación con los métodos coprológicos (Reichel, 2002; Vercruysse y Claerebout, 2001).
El control y el manejo de F. hepatica a través de métodos diagnósticos tempranos adecuados permiten un eficiente diagnóstico de la enfermedad y la implementación de tratamientos antihelmínticos oportunos y adecuados, contribuyendo a prevenir el desarrollo de resistencias antiparasitarias (Fairweather et al., 2020; Kamaludeen et al., 2019; López Corrales et al., 2021). Por consiguiente, es fundamental que la investigación sobre la infección por trematodos hepáticos sea enfocada en la identificación de factores de riesgo asociados que permitan obtener información para formular y ejecutar programas sanitarios idóneos que disminuyan las tasas de infección por Fasciola y generen una mejora de la eficiencia productiva de los rebaños (Pérez-Creo et al., 2016).
En los sistemas de producción pecuaria en Colombia se han reportado altas prevalencias de la enfermedad mediante técnicas coprológicas, especialmente en bovinos, con datos que oscilan entre un 25 % y un 80 % en Boyacá, Nariño y Cundinamarca (Giraldo Pinzón et al., 2016; Pinilla León, Uribe Delgado y Florez, 2019; Pulido Villamarín, Castañeda Salazar y Arbeláez, 2011; Recalde-Reyes et al., 2014). Sin embargo, en los rebaños ovinos hay un número limitado de estudios de diagnóstico. Recientemente, Pinilla et al. (2020a) reportaron una prevalencia del 14,4 % en ovinos de Santander y Boyacá. A pesar de los avances epidemiológicos de fasciolosis, es necesario continuar con el estudio de la enfermedad. Por lo tanto, el objetivo de esta investigación fue determinar la seroprevalencia de F. hepática en ovinos de Boavita, Boyacá (Colombia).
Metodología
Ubicación geográfica
Boavita es un municipio ubicado en la provincia norte del departamento de Boyacá, con aproximadamente con 8.700 habitantes distribuidos en el área urbana y rural, esta última cuenta con trece veredas. Tiene una extensión total de 159 km2, altitud de 2.114 msnm y una temperatura promedio de 18-24° C (Alcaldía de Boavita, 2020).
Tamaño de la muestra
Teniendo en cuenta el censo pecuario realizado por el Instituto Colombiano Agropecuario (ICA) en el año 2019, la población ovina registrada en Boavita fue de 1350 ovinos (Instituto Colombiano Agropecuario, 2019). Con esta información se determinó una muestra de 297 ovinos, considerando un error aceptado del 5 %, nivel de confianza del 95 % y tasa de prevalencia esperada del 50 %, implementado la siguiente formula:
Tamaño de la muestra n = (Z_(a⁄(2√(p(1-p)))) / E) = (Z^2 α/2∙p(1-p)) / E^2
Dónde: Z = Nivel de confianza; n = tamaño de la muestra; E = error aceptado; p = valor esperado de la proporción; α = probabilidad de cola.
Variables evaluadas
Las variables fueron divididas en dos categorías, aquellas relacionadas con el animal como edad, raza, sexo, y las asociadas a la explotación, priorizando las prácticas de manejo que implementaban en las fincas muestreadas.
Toma y procesamiento de las muestras
Se tomaron 297 muestras de sangre, las cuales fueron obtenidas a partir de venopunción yugular de los individuos, utilizando aguja calibre 16 y 18 de 3 pulgadas. Previo a la toma de la muestra de sangre se depiló y desinfectó el área con alcohol para facilitar la toma de la muestra y evitar la contaminación de la misma. Para la extracción de sangre se utilizó el sistema de tubos al vacío (tipo Vacutainer). Se extrajeron 7 ml de sangre con un tubo sin anticoagulante (Vacutainer tapa roja), el cual fue rotulado y almacenado. Una vez en el laboratorio, las muestras de sangre se centrifugaron a 2.500 r.p.m. durante 10 minutos para separar las células del suero. Luego con una pipeta Pasteur se separó el suero o sobrenadante y se transfirió a un tubo de almacenamiento hasta su procesamiento a -20° C (Figueiredo Marques, Pompei y Martini, 2017), posteriormente las muestras fueron sometidas a la técnica de enzimoinmunoanálisis de adsorción implementando el kit comercial ELISA BIO K 211 - Monoscreen AbELISA F. hepatica, siguiendo las instrucciones del fabricante.
Análisis estadístico
El estudio fue observacional, descriptivo de corte (transversal) con muestreo aleatorio simple. Con la base de datos consolidada y depurada, se establecieron los factores determinantes utilizando la razón de prevalencia (RP). La variable dependiente (Y) incluyó los resultados de serología obtenidos, mientras que las variables independientes (X) fueron todos los factores determinantes establecidos en la encuesta epidemiológica estructurada. La asociación entre la positividad al parásito y las variables evaluadas se determinó mediante la prueba exacta de Fisher. Una vez establecidos estos factores, se construyó un modelo final utilizando análisis de regresión logística, los datos fueron analizados con el programa estadístico Epi Info™.
Resultados
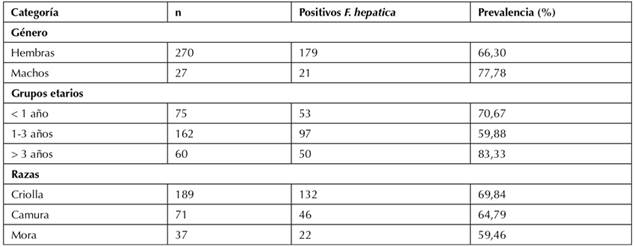
Se determinó una seroprevalencia general del 67,34 % (200/297), en donde los machos (77,78 %) fueron más prevalentes que las hembras (66,3 %). En relación con los grupos etarios, los ovinos > 3 años presentaron la seropositividad más alta (83,33 %), mientras que los individuos de 1-3 años presentaron un valor más bajo de anticuerpos (59,88 %). Así mismo, se estableció una seroprevalencia de 69,84 % para las ovejas de raza criolla, seguidas de 64,79 % en la raza camura y 59,46 % en los individuos de raza mora (Tabla 1).
Tabla 1 Seroprevalencia de F. hepática por género, grupos etarios y raza en ovinos del municipio de Boavita, Boyacá.
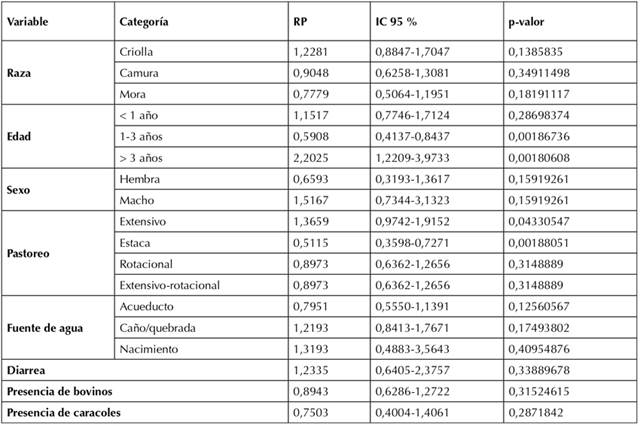
Se estableció asociación estadística significativa entre la seropositividad a F. hepatica y los ovinos de 1-3 años (p = 0,0018673587) y los individuos > 3 años (p = 0,0018060776), este grupo etario se estableció como posible factor de riesgo para la presentación de fasciolosis en los ovinos evaluados, mientras que las ovejas de 1-3 años se consideraron como factor de protección. Las variables pastoreo extensivo (p = 0,04330547) y de estaca (p = 0,0018805148) también presentaron significancia estadística, siendo este último factor de protección para la parasitosis (Tabla 2).
Tabla 2 Análisis de raza, edad, sexo y prácticas de manejo como posibles factores de riesgo asociados a parasitosis por F. hepatica en ovinos. Los resultados se presentan como razón de prevalencia (RP) e intervalo de confianza (IC) del 95 %.
La regresión logística permitió establecer el grupo etario > 3 años como factor de riesgo para la presentación de fasciolosis en los ovinos que participaron en el estudio (OR 2,8729; IC 1,3841 - 5,9629; p = 0,0046).
Las investigaciones publicadas del diagnóstico de fasciolosis en ovinos mediante serología son escasas. En el mundo se han reportado seroprevalencias del 16,2 % implementando ELISA comercial y 15,6 % mediante ELISA in-house en Turquía (Erdem, Simsek y Koroglu, 2012), 39,2 % en Pakistán (Afshan et al., 2013) 25,3 % en Galicia (España) (Pérez-Creo et al., 2016), 31,4 % en Turquía (Acici et al., 2017) 0,8 % en Etiopia (Adamu et al., 2019), 8,9 % en Duhok (Irak) (Mikaeel, 2020) y 37,1 % en la meseta Tibetana-Qinghai (China) (Gao et al., 2020); mientras que a nivel nacional se ha establecido una seropositividad del 29,9 % en ovejas de los municipios del Encino (Santander), Belén y Duitama (Boyacá) (Pinilla et al., 2020b), siendo esta seroprevalencia menor a la encontrada en nuestro estudio, en donde el 67,34 % de los ovinos presentó anticuerpos contra el trematodo.
De acuerdo con Acici et al (2017), la alta frecuencia de infección por el trematodo se puede deber a la técnica de serodiagnóstico utilizada, el tamaño de la muestra y la ubicación de los animales; ya que en aquellos lugares donde la precipitación anual es mayor se puede asociar con la alta humedad del suelo que provee las condiciones medioambientales adecuadas para la supervivencia del parásito y de su hospedador intermediario en las producciones de pequeños rumiantes; de allí que en investigaciones realizadas por Arifin, Höglund y Novobilský (2016) se haya establecido alta seroprevalencia a F. hepatica tras comparar técnicas diagnósticas convencionales y moleculares, obteniendo una seroprevalencia mediante ELISA del 74,35 %, valor cercano al obtenido en los ovinos del presente estudio.
Asimismo, el alto porcentaje de ovejas expuestas al parásito indica una importante contaminación de los pastos con metacercarias de F. hepatica. Por tanto, se deben establecer medidas de control de fasciolosis en las explotaciones ovinas, además de la implementación de medidas de control integrado, incluyendo tratamientos antihelmínticos estratégicos efectivos, prácticas de manejo de animales y pastos, principalmente en grupos de riesgo como ovejas de mayor edad y pequeños rebaños, y la aplicación de medidas ambientales orientadas a reducir las poblaciones de caracoles en el área es necesaria para para reducir el riesgo de exposición (Pérez-Creo et al., 2016).
En el presente estudio, el grupo etario de mayor edad presentó la seroprevalencia más alta, lo que coincide con lo reportado por Pérez-Creo et al. (2016), quienes determinaron una seroprevalencia de 26,8 %, con Mikaeel (2020), indicando una seropositividad de 11,3 %, y con Gao et al. (2020), con una presencia de anticuerpos del 46,1 % en los individuos adultos. No obstante, nuestros resultados difieren con lo establecido por Pinilla et al. (2020b) con una mayor seroprevalencia en los ovinos de 1-2 años; por otra parte, se encontró asociación estadística significativa con la presentación de F. hepatica y la edad de los ovinos, lo cual concuerda con Afshan et al. (2013), Pérez-Creo et al. (2016), Gao et al. (2020) y Pinilla et al. (2020b), que establecieron significancia estadística con los grupos etarios.
En nuestros hallazgos, los individuos > 3 años se establecieron como factor de riesgo para infección por F. hepatica en los ovinos muestreados (OR 2,2025 IC 1,2209 - 3,9733 p = 0,00180608). Los datos obtenidos en nuestro estudio divergen con lo reportado por Gao et al. (2020) en donde los grupos etarios ovinos de 1-2 años y > 2 años fueron considerados como factor de riesgo para la trematodiasis. Las ovejas adultas tienen mayor riesgo de ser positivas que los animales jóvenes, por lo que en el presente estudio los individuos del primer grupo etario en mención tienen una mayor probabilidad de adquirir la infección.
Pérez-Creo et al. (2016), Gao et al. (2020) y Pinilla et al. (2020b) reportaron una seroprevalencia mayor a la parasitosis en hembras ovinas. Sin embargo, nuestros resultados determinaron mayor seropositividad en los machos; así mismo, no se encontró asociación estadística significativa con el género, lo cual no concuerda con lo reportado por Afshan et al. (2013), quienes si establecieron la relación. No obstante, se debe indicar que ambos sexos comparten las tierras de pastoreo, lo que permite el consumo de metacercarias tanto por hembras como por machos y la fasciolosis es una enfermedad que no está directamente relacionada con el sexo de los hospedadores a los cuales parasita, de allí que todos los ovinos evaluados estén en riesgo de infección.
No se encontró asociación estadística significativa entre la seropositividad a fasciolosis y la presencia del hospedador intermediario en las fincas evaluadas en este estudio (p ≥ 0,05). Pinilla et al. (2020b) establecieron significancia estadística con el caracol de la familia Lymnaeidae considerándolo como factor de riesgo para la parasitosis, ya que se determinó un alto valor de seroprevalencia en los animales muestreados. Sumado a esto, es importante mencionar que los huevos de F. hepatica ingresan al medio ambiente a través de las heces de los huéspedes definitivos como los ovinos y luego buscan activamente caracoles Lymnaea como huéspedes intermediarios en forma de miracidios que nadan libremente, estos moluscos liberan cercarias que se enquistan en las plantas como metacercarias que infectan a los pequeños rumiantes (Gayo, Cancela y Acosta, 2020; Hu et al., 2021; Pan et al., 2022); por tanto, el caracol actúa como indicador epidemiológico y de infección por Fasciola spp en los potreros, ya que Pan et al. (2022) reportan que los caracoles positivos están involucrados en la transmisión de fasciolosis a animales o humanos.
La asociación estadística significativa encontrada con el pastoreo extensivo y en estaca (p ≤ 0,05) estableció al manejo en estaca como factor de protección para la parasitosis en el presente estudio, ya que al mantener a los individuos en un mismo lugar se disminuye el riesgo de adquisición y diseminación de la infección. Regea y Getachew (2021) indican que la prevalencia a F. hepatica puede variar dependiendo de las prácticas de manejo de las explotaciones, además, se ha reportado que el aumento de las prevalencias de fasciolosis se ha asociado al pastoreo de ovejas en áreas ambientalmente sensibles (Charlier et al., 2014; Pritchard et al., 2005).
El manejo y el control estratégico de la fasciolosis en las producciones ovinas dependen de la evaluación temprana de la extensión de la enfermedad para que las medidas de control puedan implementarse rápidamente. Tradicionalmente, esto se ha basado en la detección de huevos en las heces de los animales, un método laborioso que carece de sensibilidad, especialmente para infecciones subclínicas y útil en el diagnóstico de infecciones crónicas. En este sentido, la implementación de los ensayos inmunoabsorbentes ligados a enzimas (ELISA) ofrece un medio de diagnóstico serológico más rápido y sensible que podría detectar una infección aguda temprana antes de que ocurra un daño hepático significativo (López Corrales et al., 2021).
Conclusiones
La alta seroprevalencia de fasciolosis en los ovinos evaluados (67,34 %) evidencia la diseminación de la infección por F. hepatica en ejemplares ovinos y confirman la importancia de los métodos serológicos para el diagnóstico de la enfermedad. La identificación temprana de la infección y el establecimiento de los factores de riesgo asociados a la presentación de la misma como el grupo etario ovino de 3 años influencian la implementación de planes de prevención y control que conlleven a la disminución de las pérdidas económicas de los productores ovinos derivadas por la trematodiasis.















