Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universidad y Salud
Print version ISSN 0124-7107On-line version ISSN 2389-7066
Univ. Salud vol.12 no.1 Pasto Jan./Dec. 2010
CARACTERIZACIÓN DEL ACEITE ESENCIAL PRESENTE EN LAS HOJAS DE Phyla nodiflora (L.) Greene (OROZUL)
CHARACTERIZATION OF ESSENTIAL OIL PRESENT IN THE LEAVES OF Phyla nodiflora (L.) Greene (OROZUL)
Olga Lucía Benavides Calvache1, Johana Mireya Villota2, Darmely Milena Tovar3
1 Magíster en Ciencias-Química con énfasis en Productos Naturales. Docente Tiempo Completo. Facultad de Ingeniería Agroindustrial. Universidad de Nariño. Pasto. e-mail: olgalucia@udenar.edu.co
2 Química. Docente. Colegio San Francisco Javier. Pasto. e-mail: johanavillot@hotmail.com
3 Química. Analista Química. Corponariño. Pasto. e-mail: milena_tovar_m@yahoo.es
Fecha de recepción: Junio 23 - 2010 / Fecha de aceptación: Septiembre 03 - 2010
RESUMEN
Se caracterizaron los compuestos mayoritarios presentes en el aceite esencial de las hojas de Phyla nodiflora (L.) Greene (Orozul), planta reconocida tradicionalmente por sus cualidades medicinales especialmente para el tratamiento de afecciones estomacales y respiratorias. Los compuestos fueron extraídos mediante la técnica de hidrodestilación asistida por radiación con microondas (MWHD), identificados mediante la técnica GC-MS y cuantificados por el método del estándar interno empleando n-tetradecano como patrón. La mayoría de compuestos extraídos son de tipo monoterpeno y sesquiterpeno.
Palabras clave: Phyla nodiflora (L.) Greene, orozul, aceite esencial, planta medicinal, terpenos.
ABSTRACT
The main compounds in essential oil of leaves of Phyla nodiflora (L.) Greene (Orozul) were characterized. This plant is traditionally recognized for their medicinal qualities especially in the treatment of stomach and respiratory ailments. The compounds were extracted by hydrodistillation technique assisted by microwave radiation (MWHD), identified by GC-MS technique and quantified by internal standard method using n-tetradecanoic as standard. Most extracted compounds are monoterpene and sesquiterpene type.
Key words: Phyla nodiflora (L.) Greene, orozul, essential oil, medicinal plant, terpenes.
INTRODUCCIÓN
La especie vegetal Phyla nodiflora (L.) Green pertenece a la familia Verbenaceae, y se caracteriza por ser una planta arvense resistente a la sequía, de tallo cuadrangular, hojas opuestas, perennes, ovales y rugosas; sus flores agrupadas en espigas terminales pueden ser blancas o violetas.1 Moldenke comparó descripciones taxonómicas de varias especies de plantas y concluyó que el género Phyla hace parte del género Lippia,2,3 motivo por el cual es también conocida con el nombre científico de Lippia nodiflora (L.) Greene o Lippia nodiflora (L.) Michx.4 Esta planta se considera nativa de Estados Unidos, pero se encuentra ampliamente distribuida en América Central, Sur América, África y el Medio Oriente.5 En el Departamento de Nariño (Colombia) se encuentra en abundancia en el Municipio de El Tambo, donde es conocida con el nombre común de Orozul. Tradicionalmente, las hojas de esta especie en infusión se emplean para la remediación de afecciones estomacales tales como gastritis, úlceras, reflujos y presenta una moderada actividad contra Helicobacter pylori,6 además tiene aplicación cicatrizante cuando se usa como emplasto en afecciones de la piel.7 Se conoce del uso de la especie L. nodiflora (L.) Greene como remedio para los resfriados, gripe, bronquitis y asma,8 así como para el tratamiento de la gonorrea9 y de los desórdenes menstruales.10 Esta planta presenta diversas actividades biológicas tales como: analgésica, antiinflamatoria, antipirética,11 antiespasmódica,12 antimalárica13 diurética14 y antimicrobial,15 entre otras. Esta especie tiene usos medicinales importantes dentro de grupos étnicos específicos del mundo, lo que genera en las comunidades científicas un gran interés de tipo etnofarmacológico.16
MATERIALES Y MÉTODOS
La extracción del Aceite Esencial se llevó a cabo mediante Hidrodestilación Asistida por Radiación con Microondas (MWHD), empleando un equipo Clevenger, con un balón de vidrio de 5L de capacidad, ubicado al interior de un microondas marca LG, modelo N.MB-314V6. Los análisis cromatográficos para la cuantificación de los compuestos del aceite esencial se realizaron en La Universidad de Nariño, en el equipo GC-MS Shimadzu QP 5000, con una columna DB-5 (30m*0,25mm d.i., df 0,25µm), en las siguientes condiciones: Temperatura del detector 280°C, temperatura del inyector 250°C, temperatura de la columna 40°C*5min, 5°C/min hasta 250°C*15min, Helio como gas de arrastre, flujo interno de 1mL/min, flujo total de 25mL/ min, presión 134Kpa, velocidad 40cm/s, razón split less 10, en un tiempo total de 62min.
Los espectros de masas se obtuvieron con un cromatógrafo de gases Shimadzu GC 17A acoplado a un detector selectivo de masas QP 5050, empleando una columna RTX-5 (fenilmetilsilicona, 30m*0,25mm d.i.), en las siguientes condiciones: 4 minutos a 60°C, luego se incrementó la temperatura de 60 a 320°C a 4°C/min y finalmente se dejó a 320°C por 25min, Helio como gas de arrastre a 1mL/min, split 1:10 y temperatura del inyector 320°C. Los espectros de masas se tomaron en modo de ionización electrónica a 70eV, en el rango de 40 a 400µ. Se empleó diclorometano grado HPLC (Aldrich Chemical Co) como solvente de dilución; n-tetradecano grado HPLC (Merck- Schuchardt) como patrón de estándar interno y sulfato de sodio anhidro grado analítico (Merck-Schuchardt) como agente desecante. La identificación de los compuestos del aceite esencial se hizo por comparación de espectros de masas, por análisis de fragmentación de masas y por correlación con la base de datos de la biblioteca WILEY139.LIB.
Material vegetal. Las hojas de Phyla nodiflora (L.) Green fueron recolectadas mediante un muestreo completamente aleatorio en una zona silvestre del municipio de El Tambo en el departamento de Nariño (altura de 2.250 m.s.n.m., precipitación media anual de 1.199 mm y temperatura promedio de 18°C), en etapa de floración durante la época de verano. Las muestras se secaron al medio ambiente protegidas de la humedad. La identificación taxonómica se realizó en la Universidad del Cauca, en el Museo de Historia Natural.
Diseño experimental. Se empleó un Diseño irrestrictamente al azar,17 basado en el mayor número de compuestos extraídos, en cuatro tratamientos con tres repeticiones, como se registra en la Tabla 1. Además fue posible evaluar la variabilidad de cada tratamiento mediante la aplicación de un análisis de varianza (ANDEVA), con α = 0,05.
En cada caso, se emplearon 150 g de hojas secas molidas y un litro de agua destilada como solvente.
Las muestras de aceite esencial obtenidas se colectaron en viales, se secaron con sulfato de sodio anhidro y se almacenaron en refrigeración a 2°C.
Preparación de las muestras. De cada muestra de aceite esencial extraído se tomó una alícuota de 0,3 mL y se diluyó en 1 mL de diclorometano, luego se adicionó 0,4 µL de n-tetradecano como estándar interno, para la posterior cuantificación de los compuestos del aceite esencial. El factor de respuesta cromatográfica del estándar interno se calculó a partir de la pendiente de la recta que se origina con diferentes concentraciones de n-tetradecano y las áreas cromatográficas del mismo.18
RESULTADOS Y DISCUSIÓN
En la Tabla 2, se observa el promedio del número de compuestos obtenidos en el aceite esencial por Hidrodestilación Asistida por Radiación con Microondas.
El análisis ANDEVA (G.L= 11; α= 0,05; F. cal.= 6,95; F. tab.= 8,84) realizado según el número de compuestos extraídos en los diferentes tratamientos, indica que no existe diferencia significativa entre los tratamientos aplicados para la extracción del aceite esencial de Orozul por Hidrodestilación Asistida por Radiación con Microondas, por lo tanto, es posible elegir cualquier tratamiento para la extracción del aceite esencial.
Identificación de los compuestos del aceite esencial. De los análisis obtenidos por GCMS se realizó la identificación de los compuestos mayoritarios del aceite esencial de las hojas de Orozul, mediante comparación espectral19 y por fragmentación de masas. La identidad de los compuestos presentó una confiabilidad mayor del 90%, según la respuesta de la biblioteca WILEY139.LIB. En el Gráfico 1 se muestra el perfil cromatográfico de los compuestos identificados, junto al patrón estándar de cuantificación (Istd).
En la Tabla 3, se relaciona la identificación de los compuestos mayoritarios extraídos en el aceite esencial de las hojas de P. nodiflora (L.) Greene.
Cada compuesto se indica con un número entero. El compuesto número 6 corresponde al estándar interno (n-tetradecano) adicionado a la muestra con fines de cuantificación.
La identidad de los sesquiterpenos obtenidos se comprobó mediante comparación con una base de datos de espectros de masas para este tipo de hidrocarburos,20 obteniéndose así, espectros coincidentes en la mayoría de los picos más abundantes.
Los compuestos extraídos se clasifican como monoterpenos (limoneno, carvona, piperitona y verbenona), sesquiterpenos (calareno y muroleno) y un hidrocarburo saturado (3-metiltridecano). Los picos diagnósticos de la fragmentación por MS de los compuestos identificados, que se realizó en esta investigación, con base en la teoría de la espectrometría de masas,21 se presentan a continuación:
Compuesto 1. Presenta un ion molecular a m/z 136, correspondiente con la fórmula molecular C10H16. En su espectro de masas se observan iones a m/z 121[M+-CH3], 107 [M+-CH3-CH2], apertura del anillo aromático con sucesivas pérdidas de grupos metilenos hasta la obtención del pico a m/z 67 propio del catión ciclopenteno, el ion a m/z 93 sufre la pérdida de un grupo CH2 y por un proceso retro Diels-Alder se transforma en el ión a m/z 53 equivalente al catión ciclobuteno.
Compuesto 2. Su ion molecular es de 150 uma, consecuente con la fórmula molecular C10H14O. La molécula de carvona sufre apertura del anillo aromático, descarboxilación y pérdida de la cadena lateral para transformarse en el pico base m/z 82, éste a su vez puede perder un grupo metilo para convertirse en el ion m/z 67 correspondiente al catión 3-metilciclobuteno.
Compuesto 3. Su espectro de masas visualiza un pico molecular a m/z 152 y su fórmula molecular es C10H16O. Presenta iones a m/z 137 [M+-CH3], el cual puede transformarse en su correspondiente cetena y a su vez perder la cadena lateral para convertirse en el ion m/z 95. En una ruta paralela, la cetena del ion molecular puede perder el grupo isopropilo para dar origen al ion m/z 110, que a su vez puede producir el catión radical metilciclopenteno de m/z 82.
Compuesto 4. Este metabolito tiene su ion molecular a m/z 150, que concuerda con su fórmula molecular C10H14O. El ion molecular se desmetila para convertirse en el ion m/z 135. La cetena del ion molecular sufre la apertura de su anillo interno y una desmetilación para dar origen al ion m/z 107. Paralelamente, el ion molecular puede descarboxilarse y sufrir la apertura del anillo interno para convertirse en dos moléculas de cuatro átomos de carbono y una instauración correspondientes al ion m/z 53.
Compuesto 5. Su ion molecular corresponde a 198 uma y su fórmula molecular a C14H30. En su espectro de masas se observa un pico a m/z 169 [M+-CH3-CH2], éste a su vez puede perder cuatro grupos metilenos para originar el pico a m/z 113 o sufrir la pérdida de seis grupos metileno para formar el pico a m/z 85. Por otra parte, el ion molecular pierde la cadena saturada de diez carbonos para producir el ion a m/z 57.
Compuesto 7. Este sesquiterpeno presenta su ion molecular a m/z 204 consecuente con la fórmula molecular C15H24. En su espectro se observan iones a m/z 189 [M+-CH3], éste puede perder luego un grupo etilo (de la apertura del ciclopropano) para originar el ion a m/z 161, éste último pierde un grupo metilo para formar el ion a m/z 147. El catión a m/z 147 sufre la apertura del anillo saturado y una posterior pérdida de un grupo etilo para dar origen al pico base a m/z 120. El pico base pierde un radical de 15 uma y formar el catión a m/z 105.
Compuesto 8. Presenta un ion molecular a m/z 204, cuya fórmula molecular corresponde a C15H24. El ion molecular pierde un grupo isopropilo para constituir el pico base a m/z 161. Éste a su vez puede sufrir la pérdida de un grupo metilo y originar el pico a m/z 147. Éste último puede generar los picos a m/z 133 (catión metil- 1,3,7-ciclononatrieno) y m/z 119 (catión metil- 1,3,6-ciclooctatrieno) por pérdida sucesiva de grupos metileno al sufrir apertura del anillo y posterior ciclación.
Estudios anteriores del aceite esencial de la especie Lippia nodiflora (L.) Greene, indican la presencia de monoterpenos y sesquiterpenos como sus componentes mayoritarios,22 además Elakovich,23 informa sobre la presencia de carvona en el aceite esencial de esta especie de Lippia.
Cuantificación de los compuestos del aceite esencial. Los compuestos identificados en el aceite esencial de las hojas de la especie vegetal Phyla nodiflora L. Greene, fueron cuantificados por el método del estándar interno (Istd) con n-tetradecano.
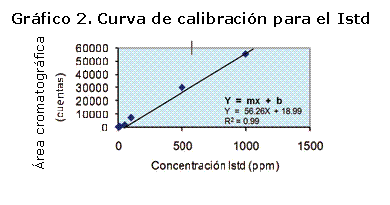
Las concentraciones de n-tetradecano empleadas para la elaboración de la curva de calibración junto a sus áreas cromatográficas, al igual que el análisis estadístico realizado para el cálculo del Factor de respuesta se indican en la Tabla 4. La curva de calibración para el estándar interno se muestra en la Gráfico 2.
En el análisis estadístico se obtuvo un coeficiente de variación que no superó el 5%, lo cual comprueba que existe poca variación en los datos obtenidos para el área cromatográfica del estándar interno.
En la ecuación de la recta, la pendiente representa el Factor de respuesta del estándar interno, el cual corresponde a 56,26 cuentas*L/ mL, equivalente a 73735,25 cuentas*L/mg, cuyo valor fue empleado para el cálculo de las concentraciones de cada compuesto del aceite esencial.
Los valores de concentración de los compuestos del aceite esencial de las hojas de Orozul se indican en la Tabla 5.
Los compuestos que se encuentran en mayor proporción en el aceite esencial de orozul son el limoneno y la carvona, mientras que el 3-metiltridecano representa el compuesto con la menor concentración. El limoneno es el monoterpeno cíclico más abundante en la naturaleza y es el componente principal del aceite esencial de los frutos cítricos. Además es el precursor de otros compuestos volátiles tales como la carvona debido a la oxidación que sufre en C6.24
Los dos monoterpenos mayoritarios identificados en P. nodiflora, también hacen parte de los compuestos volátiles presentes en otras especies del género Lippia, tal es el caso de L. fissicalyx Tronc., L. polystachia Griseb; así como también L. alba, especie en la cual se han realizado estudios de estos compuestos para la definición de quimiotipos.25 De hecho, una investigación realizada en cinco aceites de L. alba quimiotipo carvona-limoneno, demostró la actividad antifúngica de estas especies contra A. fumigatus y C. krusei. El quimiotipo de mayor actividad estuvo relacionado con la composición mayoritaria de limoneno y carvona en su aceite esencial,26 lo que hace pensar que P. nodiflora, también puede presentar actividad antifúngica. Por otro lado, se ha determinado que los monoterpenos limoneno y carvona, pueden exhibir propiedades profilácticas y curativas contra el cáncer de piel, hígado, pulmón, páncreas y mamario; además de revertir la formación de tumores malignos mediante apoptosis.27 Lo anterior proyecta a la especie P. nodiflora como una planta con posible actividad anticancerígena.
AGRADECIMIENTOS
Los autores agradecen al Químico David Perdomo de la Universidad de Nariño, por la toma de los cromatogramas; a la Doctora Coralia Osorio de la Universidad Nacional de Colombia, por la toma de los espectros de masas; al Químico Dairo Portillo por su colaboración en el análisis espectral; al Doctor Bernardo Calvache, de la Universidad del Cauca, por la identificación taxonómica de la especie vegetal y al Médico Terapeuta Vilson Sánchez por el financiamiento parcial de la investigación.
REFERENCIAS
1. Duke J. Phytochemical and ethnobotanical databases. Chemical verbenaceas. 2001. http:/www.crat/chemical_ethnobotanical_unb/verbenaceas.org.htm [ Links ]
2. Moldenke HN. A fifth summary of the verbenaceae, avicenniaceae, stilbaceae, dicrastylidaceae, symphoremaceae, nyctanthaceae and eriocaulaceae of the world as to valid taxa, geographic distribution and synonymy. 1971. U.S.A. [ Links ]
3. Moldenke HN. Phytologia memoirs ii. a sixth summary of the verbenaceae, avicenniaceae, stilbaceae, chloanthaceae, symphoremaceae, nyctanthaceae and eriocaulaceae of the world as to valid taxa, geographic distribution and synonymy. 1980. U.S.A. [ Links ]
4. Rimpler H, Sauerbier H. Iridoid glucosides as taxonomic markers in the genera Lantana, lippia, aloysia and phyla. Biochemical systematic and ecology. 1986; 14, 307-310. [ Links ]
5. Tomás FA, Harbone JB, Self R. Twelve 6-oxy-genated flavone sulphates from lippia nodiflora and lippia canescens. Phytochemistry. 1987; 26, 2281-2284. [ Links ]
6. FEMS. Herbs deriving from Taiwanese folk medicinal plants. Department of Food Science National Chung-Hsing University. Immunology and medical microbiology. 2004; 23(2), 1. [ Links ]
7. Thas J. Shida medicine-background and principles and the application for skin diseases. Clinics in dermatology. 2008; 26, 62-78. [ Links ]
8. Pousset JL. Plantes médicinales Africaines. Ellipses. Agence de Coopération Culturelle et technique, Paris, 1989; 102-103. [ Links ]
9. Zamora MC, Nieto C. Medicinal plants used in some rural populations of Oaxaca, Puebla and Veracruz, Mexico. Journal of Ethnopharmacology. 1992; 35, 229-257. [ Links ]
10. Compadre CM, Robbins EF, Kinghorn D. The intensely sweet herb, lippia dulcis Trev: Historical uses, field inquiries and constituents. Journal of Ethnopharmacology. 1986; 15, 89-106. [ Links ]
11. Forestieri AM, Monforte MT, Ragusa S, Trovato A, Iauk L. Antiinflammatory, analgesic and antipyretic activity in rodents of plant extracts used in Africa medicine. Phytotherapy research. 1996; 10, 100-106. [ Links ]
12. Schauenberg P, Paris F. Guía de las plantas medicinales. Ediciones OMEGA, Barcelona, 1977; p. 266. [ Links ]
13. Gasquet M, Delmas F, Timón P, Feita A, Guindo M, Koita N, Diallo D, Doumbo O. Evaluation in vitro and in vivo of a tradicional antimalarial, malarial-5 fitoterapia. 1993; 64, 423-426. [ Links ]
14. Hutchings A, van Staden J. Plants used for stress-related ailments in traditional Zulu, Xhosa and Sotho medicine. Part I: Plants used for headaches. Journal of Ethnopharmacology. 1994; 43, 89-124. [ Links ]
15. Mukherjee T. Antimalarial herbal drugs. A review. Fitoterapia. 1991; 62, 197-204. [ Links ]
16. Mollik, et al. Some weeds used by Rakhain, the ethnic group of Chittagong Hill Tracts, Bangladesh, to treat various ailments. In Vitro Cell.Dev.Biol.-Animal 12Th World Congress Abstract. 2010; P-118. [ Links ]
17. Legarda L, Lagos T, Vicuña L. Diseño de experimentos agropecuarios. Unigraf. San Juan de Pasto. 2001; p. 38-39. [ Links ]
18. Grob R. Modern practice of gas chromatography. 2005. http:/www.healhphone/oilessences/istdGC/consup/uk.htm [ Links ]
19. Adams R. Identification of essential oil components by gas chromatography/ quadruple mass spectroscopy. Allured Publishing Corporation. Illinois. 2004; 456 p. [ Links ]
20. Joulain D, König, W. The atlas of spectral data of sesquiterpene hydrocarbons. E.B. Verlag Hamburg. Alemania. 1998; p. 205, 475-479. [ Links ]
21. Silverstein RM, Clayton G, Morril T. Spectrometric identification of organic compounds. John Wiley & Sons, Inc. New York. 1991; p. 44-88. [ Links ]
22. Terblanché FC, Kornelius G. Essential oil constituents of the genus lippia (Verbenaceae)- A literature review. Journal of essential oil research. 1996; 8, 471-485. [ Links ]
23. Elakovich S. Volatile constituents of Lippia nodiflora. Journal of Natural Products. 1985; 48(3), p. 503-506. [ Links ]
24. Castellanos F, Perea A, Ortiz C. Obtención de alcohol perílico por biotransformación del limoneno. Scientia et Technica. Año XIII (33), 2007; p. 137. [ Links ]
25. Durán D, Monsalve L, Martínez J, Stashenko E. Estudio comparativo de la composición química de aceites esenciales de lippia alba provenientes de diferentes regiones de Colombia, y efecto del tiempo de destilación sobre la composición del aceite. Scientia et Technica. Año XIII (33), 2007; p. 435-438. [ Links ]
26. Montiel J, Mesa A, Durán C, Bueno J, Betancur L, Stashenko E. Evaluación de la actividad anti-cándida y anti-aspergillus de aceites esenciales de Lippia alba (Miller) N.E. Brown quimiotipo carvona-limoneno y su asociación con sus componentes mayoritarios. Scientia et Technica Año XIII (33), 2007; p. 243-246. [ Links ]
27. Drago M, López M, Sainz T. Componentes bioactivos de alimentos funcionales de origen vegetal. Revista Mexicana de Ciencias Farmacéuticas. 2006; 37(004), p. 58-68. [ Links ]