Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.60 no.2 Medellín July/Dec. 2007
SELECCIÓN Y REGENERACIÓN in vitro DE SOMACLONES DE TOMATE DE ÁRBOL (Solanum betacea cav. Sendt) UTILIZANDO FILTRADOS DE CULTIVO DE Colletotrichum acutatum CON ACTIVIDAD PECTINASA
SELECTION AND in vitro REGENERATION OF SOMACLONES OF TREE TOMATO (Solanum betacea cav. Sendt) USING CULTURE FILTRATES OF Colletotrichum acutatum WITH PECTINASA ACTIVITY
Carlos Patiño Torres1; Rodrigo Hoyos Sánchez2 y Lucía Afanador Kafuri3
1 Profesor. Universidad del Pacífico. Tecnología en Agronomía del Trópico Húmedo. Avenida Simón Bolivar, No. 54 A -10 - Los Laureles. Buenaventura, Colombia <cpatinot@unipacifico.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <rhoyos@unalmed.edu.co>
3 Profesora Asociada. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <lafanado@unalmed.edu.co>
Recibido: Noviembre 29 de 2006; aceptado: Septiembre 18 de 2007.
RESUMEN
Se utilizaron filtrados de cultivo de Colletotrichum acutatum, agente causal de la antracnosis del tomate de árbol, para la selección in vitro de variantes somaclonales de ésta planta con resistencia potencial a la enfermedad. El filtrado, utilizado a varias concentraciones, demostró ser un agente de selección efectivo cuando se integró al medio de cultivo, pues causó niveles elevados de mortalidad de los explantes comparado con los tratamientos sin filtrado. Igualmente, se estudió el efecto de la benziladenina (BA ó BAP) sobre la respuesta organogénica de explantes de tejido foliar de tomate de árbol.
Palabras claves: C. acutatum, tomate de árbol, tamarillo, antracnosis, cultivo de tejidos, variación somaclonal, resistencia a enfermedades
ABSTRACT
Culture filtrates of Colletotrichum acutatum, causal agent of the anthracnose disease in tree tomato, were used for the in vitro selection of somaclonal variants with potential resistance to this disease. Culture filtrates used at different concentrations, showed to be an effective agent of selection when they were mixed with the growth media. The findings indicated a high level of mortality for the explants growing on the ammended media as compared with these growing on non ammended one. The effect of the benziladenina (BA ó BAP) on the organogenic response of leaf explants of tomato tree was also studied.
Key words: C. acutatum, tomato tree, tamarillo, anthracnose, tissue culture, somaclonal variation, disease resistance
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS
RESULTADOS
 DISCUSIÓN
DISCUSIÓN
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
La enfermedad de la antracnosis producida por el hongo Colletotrichum acutatum es una de las principales limitantes de cultivo de tomate de árbol (Solanum betacea cav. Sendt) en Colombia y en muchos otros países productores, causando pérdidas de hasta el 100% en casos extremos (Villa Londoño, 1999).
Aunque el control de la enfermedad se ha basado principalmente en medidas de tipo químico, las mismas son ineficientes y plantean serios inconvenientes en lo ambiental y en lo económico. Alternativamente, se han buscado fuentes de resistencia natural a la enfermedad en otras especies relacionadas como lo reportó Lobo, Medina y Cardona (2000), con la especie Cyphomandra uniloba. Más aún, para el tomate de árbol los procedimientos de mejoramiento convencional no son fáciles de ejecutar debido a su naturaleza alógama, arbustiva y en algunos casos poliploide de algunas variedades; también como consecuencia, de la escasa caracterización disponible para ésta especie a nivel fenotípico y molecular. Resulta difícil, obtener plantas a partir de cruzamientos interespecíficos, ya que existe baja viabilidad de semillas (Obando, Goreux y Jordan, 1992).
Es bien conocido que la resistencia que poseen algunas variedades vegetales a patógenos productores de fitotoxinas puede estar asociada a su falta de sensibilidad hacia estas o a la capacidad de desplegar mecanismos que permiten su degradación o inactivación. C. acutatum produce en cultivo líquido enzimas tipo pectinasas (Patiño, Hoyos y Afanador, 2006; Fernando, Jayashinge y Wijesundera, 2001) y ácido indolacético (Robinson, Riov y Sharon, 1998; Chung et al., 2003), sustancias que están posiblemente implicadas en su interacción patogénica con varias especies vegetales. Otros hongos del mismo género son productores reconocidos de metabolitos de bajo peso molecular con actividad fitotóxica (García y Collado, 2003).
El empleo de fitotoxinas para la obtención de material resistente a enfermedades a través de procesos de selección in vitro, es una técnica ampliamente utilizada desde hace ya varias décadas, con resultados exitosos en varias especies y para varios patógenos de importancia comercial (Daub, 1986; vânová and Lebeda, 2005).
Estudios en los que se utilizaron filtrados de cultivo que contenían pectinasas (Orlando, Magro y Rugini, 1997) o metabolitos secundarios (Jayasankar et al., 1999) producidos por Rhizoctonia fragarie o C. gloeosporioides, respectivamente, han demostrado que la selección in vitro, puede generar variantes genéticos o epigenéticos (somaclones) que presentan algún grado de tolerancia/resistencia a la enfermedad causada por el patógeno in vivo. De hecho, en varios ensayos realizados en laboratorio o campo con diferentes especies han puesto en evidencia que los somaclones generados por los procesos de selección han producido progenie que conservó la característica de resistencia adquirida en la fase de cultivo de tejidos (Ahmed et al., 1996; vânová and Lebeda, 2005).
El propósito de éste estudio fue determinar el efecto fitotóxico de los filtrados de cultivo de C. acutatum sobre explantes foliares de tomate de árbol desarrollados in vitro, para su posterior uso como agentes de selección, con el fin de obtener material de tomate de árbol tolerante- resistente a la enfermedad de la antracnosis. Igualmente se determinó el efecto de la citocinina 6-benzilaminopurina (BAP) sobre las respuestas organogénicas de los explantes sometidos o no a la acción del filtrado fitotóxico.
Producción de filtrados crudos. El aislado de C. acutatum utilizado se obtuvo a partir de frutos de tomate de árbol que presentaban lesiones características, fue donado por el laboratorio de Sanidad Vegetal de la Universidad Nacional de Colombia Medellín. Para la producción de los filtrados con actividad pectinasa se procedió de acuerdo a los estudios de Patiño, Hoyos y Afanador (2006).
Selección in vitro y regeneración de variantes somaclonales de tomate de árbol. Para la obtención y regeneración de variantes somaclonales de tomate de árbol con resistencia potencial a la antracnosis se estudiaron los efectos de dos factores: concentración de la citocinina 6-benzilaminopurina (BAP) y concentración de filtrado fitotóxico. Para ello se estableció un experimento bifactorial con 4 niveles de concentración de BAP correspondientes a 0, 1, 2 y 3 mg · L-1 en medio de cultivo básico (Murashige y Skoog, 1962); y 3 niveles de concentración de filtrado con actividad fitotóxica.
Para establecer la concentración de filtrado fitotóxico como agente de selección en el medio de cultivo se opto por el siguiente procedimiento: del filtrado obtenido mediante la fermentación en medio MS durante dos semanas, se tomaron dos litros, uno de ellos se colocó en estufa a 40°C para permitir la evaporación lenta y constante hasta alcanzar 500 mL; el otro litro se dejó evaporar hasta obtener 250 mL de filtrado, con el fin de alcanzar una concentración relativa de 2x para el primero y 4x para el segundo. La temperatura elegida de 40°C se determinó previamente como la más adecuada para la evaporación, debido a que en ensayos anteriores (datos no publicados) demostró no tener efecto sobre la actividad fitotóxica del filtrado cuando se probó sobre los frutos de tomate de árbol.
Los niveles estudiados de concentración de agente selectivo (filtrados fitotóxicos) correspondieron entonces a la adición en una concentración del 10% v/v al medio de cultivo MS, del filtrado en las dos concentraciones, 2x y 4x. El tercer nivel de concentración del filtrado correspondió al testigo, es decir sin adición del filtrado. La Tabla 1 resume los tratamientos evaluados.
Tabla 1. Matriz de tratamientos evaluados para la obtención de variantes somaclonales de tomate de árbol sometidos a selección in vitro con filtrados fitotóxicos de Colletotrichum acutatum.

Los explantes que se sometieron al proceso de selección in vitro consistieron en segmentos foliares provenientes de plántulas de tomate de árbol variedad común desarrolladas y conservadas in vitro en el laboratorio de Micropropagación de la Universidad Nacional de Colombia, Sede Medellín. Los segmentos de aproximadamente 25-35 mm2 fueron tomados únicamente a partir de la primera y segunda hojas, contadas desde el extremo apical, las cuales previamente demostraron ser las más adecuadas para los procesos de morfogénesis y regeneración in vitro.
Se utilizó medio de cultivo básico M & S (1962) suplementado con, 3% sacarosa; 0,5 mg · L de ácido nicotínico, 0,5 mg · L de piridoxina, 2,0 mg · L de glicina y 0,8% de agar y pH 5,8. Los explantes se sembraron en los diferentes tratamientos con o sin filtrado. Por cada tratamiento evaluado se sembraron 110 explantes foliares en 20 ml de medio de cultivo cada uno, los cuales se mantuvieron a una temperatura de aproximadamente 25°C y un fotoperíodo de 12 horas.
La variable respuesta evaluada fue el número de brotes de vástago por explante. Los análisis estadísticos correspondientes se hicieron utilizando el procedimiento GLM (General Lineal Model) del software SAS versión 8.0. La comparación de medias se realizó con la prueba de Tukey-Kramer del mismo procedimiento.
Selección in vitro y regeneración de variantes somaclonales. Los análisis demostraron que tanto las citocininas como los filtrados, y también su interacción, contribuyen de manera eficiente en el proceso de selección in vitro.
El procedimiento GLM utilizado para el análisis de los resultados, demostró que existieron diferencias estadísticas significativas entre varios de los tratamientos. En primer lugar es de destacar que no se obtuvo ningún regenerante a partir de los explantes sembrados en medio sin BAP, independientemente de que el mismo contuviera o no filtrado fitotóxico en cualquiera de las concentraciones evaluadas. Fue evidente la acción fitotóxica del filtrado sobre los tejidos del explante ya que los mismos sufrieron procesos de pardeamiento y necrosamiento que eventualmente condujeron a la muerte de los tejidos (Figura 1).

Figura 1. Daño y muerte de los tejidos de los explantes de tomate de árbol sembrados en medio de cultivo básico (M&S, 1962) sin adición de BAP (B0) sin filtrado fitotóxico de C. acutatum (F0) o con la adición de filtrado a concentraciones relativas 2x (F2x) y 4x (F4x) después de 45 días de cultivo. Obsérvese el mayor nivel de pardeamiento y necrosamiento para el tratamiento con mayor concentración de filtrado (F4x).
El mayor número de regenerantes por explante se presentó en aquellos tratamientos en que se utilizó el medio de cultivo con BAP y sin filtrado fitotóxico; el tratamiento con mejor respuesta fue aquel con 1 mg · L de BAP, en el cual se produjeron en promedio 3,55 regenerantes por segmento foliar, seguido por el tratamiento con 3 mg · L de BAP con 2,72 regenerantes por explante y luego por el tratamiento con 2 mg · L de BAP en el que se obtuvieron 1,11 regenerantes por explante (Figura 2). Estadísticamente estos tratamientos tuvieron efectos significativamente diferentes (Tabla 2).

Figura 2. Brotes (regenerantes) obtenidos a partir de explantes foliares de tomate de árbol sometidos a los tratamientos correspondientes a las diferentes combinaciones BAP x Filtrado, después de 45 días de cultivo in vitro. B1: BAP 1 mg · L; B2: BAP 2 mg · L; B3: BAP 3 mg · L; F0: sin filtrado; F2x: Filtrado con concentración relativa 2x; F4x: Filtrado con concentración relativa 4x.
Tabla 2. Resumen de comparaciones múltiples de medias de tratamientos por la prueba de Tukey-Kramer para número de regenerantes por explante (B: BAP a concentración de 0, 1, 2 o 3 mg · L; F: Filtrado a concentración 0, 2x o 4x).

Como se observa en las Figuras 3 y 4, la adición de filtrado fitotóxico redujo significativamente la tasa de aparición de regenerantes en los explantes y en algunos casos la inhibió completamente, lo cual puede ocurrir cuando se utiliza un agente de selección adecuado.

Figura 3. Número promedio de regenerantes de tomate de árbol por explante obtenidos en los diferentes tratamientos con BAP x Filtrado. Después de 45 días de crecimiento.

Figura 4. Efecto del filtrado fitotóxico de C. acutatum sobre el número de regenerantes/explante de tomate de árbol, obtenidos a partir de las diferentes combinaciones BAP-Filtrado, después de 45 días de crecimiento.
La mayor tasa de aparición de regenerantes, de naturaleza somaclonal, se presentó en el tratamiento con 2 mg · L de BAP y filtrado a concentración 2x (Figura 2), tratamiento con el que se obtuvieron en promedio 0,25 regenerantes por explante. En términos absolutos, este tratamiento produjo 23 brotes. Los tratamientos correspondientes a la adición de la combinación de 1 mg · L de BAP y filtrado de concentración 4x y a la combinación 1 mg · L de BAP y filtrado fitotóxico de concentración 2x produjeron respectivamente 0,11 y 0,10 regenerantes por explante (Figura 2), con un número absoluto de 13 y 10 brotes respectivamente. En la combinación con 2 mg · L de BAP y filtrado a concentración 4x, se produjeron 0,07 regenerantes por explante (Figura 2) y un número absoluto de 4 brotes.
La adición de filtrado a concentraciones de 2x o 4x, en el medio de cultivo suplementado con 3 mg · L de BAP inhibió completamente la aparición de regenerantes (Figura 2). Estadísticamente, ninguno de estos tratamientos resultó ser significativamente diferente uno con respecto al otro, sin embargo, si lo fueron en relación a los tratamientos que no incluyeron el BAP en el medio de cultivo (Tabla 2).
Es interesante notar además, el efecto del BAP sobre los explantes sujetos y no sujetos a la acción del filtrado. De los explantes sembrados sobre medio sin adición de BAP, el 26% permanecieron vivos después de 45 días de sembrados, el 74% restante murieron y presentaron diferentes grados de necrosis. Cuando se adicionó BAP al medio de cultivo la tasa de supervivencia y viabilidad de los explantes se incrementó notablemente (Figura 5).
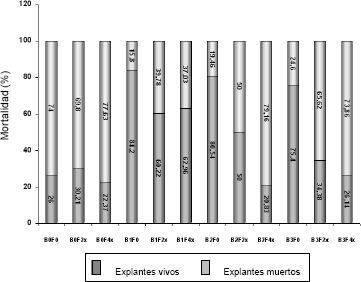
Figura 5. Mortalidad de los explantes de tomate de árbol para los diferentes tratamientos BAP x Filtrado, después de seis semanas de cultivo.
Cuando el medio contenía 1 mg · L de BAP sin filtrado, la tasa de supervivencia de los explantes fue del 84,2%; a una concentración de 2 mg · L de BAP sin filtrado se logró una supervivencia del 80,54% y con 3 mg · L de BAP y sin filtrado la misma fue del 75,4%.
La adición de BAP al medio de cultivo contrarrestó de manera significativa los efectos del filtrado fitotóxico sobre los explantes cuando ésta se aplicó a los medios de cultivo. La mortalidad de los explantes fue del 39,78% y del 37,03% para la combinación de 1 mg · L de BAP – filtrado en concentración 2x y 4x, respectivamente; 50% y 79,6% para la combinación 2 mg · L de BAP – filtrado a concentración 2x y 4x y, 65,62% y 73,86% para el tratamiento 3 mg · L BAP – Filtrado en concentración 2x y 4x, respectivamente (Figura 6).

Figura 6. Sobrevivencia de los explantes de tomate de árbol sometidos a los diferentes tratamientos BAP x Filtrado, después de 45 días de crecimiento.
La respuesta bastante notable fue la que se produjo en el caso de los tratamientos correspondientes a la adición de BAP 1 mg · L en el medio de cultivo - filtrado a concentración 2x y BAP 1 mg · L de medio de cultivo – filtrado en concentración 4x (Figura 2). Aunque no se presentó la formación de brotes de vástagos, en ambos casos y al contrario de lo que ocurrió en todos los demás tratamientos, se observó la formación de callo en los explantes. El callo de color traslúcido o pardo, se originó en las zonas de corte del explante y su desarrollo fue mayor en el tratamiento con mayor concentración relativa de filtrado fitotóxico (4x).
Una vez obtenidos los regenerantes, estos se retiraron de los medios de cultivo selectivos y no selectivos y se sembraron sobre el mismo medio de cultivo basal, con una concentración de BAP de 2 mg · L, sin filtrado fitotóxico y bajo las mismas condiciones ambientales. Después de aproximadamente 45 días los mismos habían producido suficiente ramificación para permitir su multiplicación in vitro (Figura 7).

Figura 7. Regenerantes obtenidos en el proceso de selección in vitro de tomate de árbol, a las ocho semanas de crecimiento.
Los regenerantes obtenidos se transfirieron al proceso de multiplicación para su clonación y posterior evaluación en invernadero y transferencia a campo.
La obtención de líneas resistentes a enfermedades a través del proceso de selección in vitro utilizando filtrados de cultivo de patógenos, toxinas o elicitores ha sido exitosa en banano, clavel, uva, fresa y trigo (vânová y Lebeda, 2005).
Una condición esencial en el procedimiento es la utilización de un agente de selección adecuado, que para el caso de resistencia a enfermedades pueden ser: el patógeno, sus filtrados crudos o sus toxinas purificadas. Una vez elegido el agente de selección más apto, el siguiente paso es establecer un protocolo de regeneración que permita la obtención de plántulas a un nivel eficiente y que garantice repetibilidad.
Los filtrados crudos de C. acutatum obtenidos en esta investigación mostraron su actividad fitotóxica cuando se utilizaron como agentes de selección in vitro. Aunque es difícil definir con precisión la causa de la fitotoxicidad, es probable que la misma se deba en parte a la presencia en los filtrados de enzimas tipo pectinasas (Patiño et al., 2006). El alto grado de toxicidad de los filtrados obtenidos puede valorarse a partir de los siguientes resultados (Figuras 3 y 4): mientras el tratamiento con BAP en concentración de 3 mg · L y sin adición de filtrado produjo 2,7 brotes por explante, ninguno de los tratamientos con adición de BAP en la misma concentración pero en los cuales se adicionó filtrado en concentración 2x y 4x produjo regenerante alguno. Igualmente, el número de brotes más alto obtenido para la combinación BAP-filtrado fue el correspondiente al tratamiento BAP 2 mg · L además del filtrado 2x, con 0,2526 brotes/explante, valor 14 veces más bajo que el correspondiente al obtenido con el tratamiento BAP 1 mg · L sin filtrado.
La fitotoxicidad de los filtrados utilizados se observó en la oxidación de los explantes sometidos a su acción, los cuales se tornaron de color pardo y posteriormente se necrosaron en toda su extensión.
Un aspecto importante se evidencio con la adición de citocinina (BAP) al medio de cultivo contrarrestó los efectos fitotóxicos del filtrado. Esta observación respalda el ya conocido papel de las citocininas en las respuestas de las plantas al estrés ambiental. Varios estudios han demostrado que el nivel endógeno de citocininas decrece cuando las plantas están bajo la acción de algún factor de stress (Hare, Cress y Staden, 1997). Durante el cultivo de tejidos, las células individuales o los tejidos de los explantes se desdiferencian y luego se rediferencian nuevamente dando origen a nuevos tejidos. Esta reprogramación del genoma infringe a las células y/o tejidos una serie de experiencias traumáticas (Madlung y Comai, 2004), además, teniendo en cuenta que en los cultivo de tejidos, los explantes están expuestos a diferentes condiciones de tensión (desequilibrios osmóticos, lesiones causadas en el aislamiento de los tejidos de los explantes, niveles y calidades atmosféricas anormales, etc), se puede preveer que los mismos presentan una alteración en sus niveles de citocininas y posiblemente otros reguladores.
En este estudio, la adición de BAP en concentración de 1 mg · L disminuyó notablemente los procesos de oxidación y el consecuente necrosamiento de los explantes debidos a la acción fitotóxica del filtrado. Mientras el 69,8% y el 77,63% de los explantes murieron al cabo de 45 días de cultivo en medio sin citocinina y con filtrado a concentración 2x y 4x, respectivamente, la tasa de mortalidad en los medios con BAP 1 mg · L y filtrado a concentración 2x y 4x fue del 39,78% y del 37,03%, correspondientemente (Figura 5).
Después de 45 días de cultivo, la mayor parte de los explantes sembrados en medios con citocinina (especialmente a concentración de 1 mg · L de BAP) permanecieron verdes e incrementaron su tamaño notablemente. Estos efectos probablemente estén relacionados con la capacidad de las citocininas para promover la diferenciación de cloroplastos, retrasar la senescencia foliar y coadyuvar en los procesos de división celular (Haberer y Kieber, 2002; Carimi et al., 2003).
También es interesante mencionar que cuando las concentraciones de BAP se incrementaron a 2 o 3 mg · L, las tasas de supervivencia de los explantes sometidos a la acción de los filtrados no fue muy diferente de la del testigo sin citocinina y con filtrado a la más alta concentración 4x. Con las combinaciones BAP 2 mg · L + F4x y BAP 3 mg · L + F4x se presentaron tasas de mortalidad de 79,16% y 73,86%, las cuales no difieren mucho de la del testigo que correspondió a 77,73%. Igualmente, aunque en algunos casos los explantes conservaron su color verde, estos no incrementaron en tamaño al contrario de lo que ocurrió con el tratamiento BAP 1 mg · L con o sin filtrado. Estos resultados podrían interpretarse a la luz de recientes descubrimientos en la acción de las citocininas, particularmente del BAP sobre cultivos celulares.
Carimi et al. (2003) encontraron que en cultivos de células proliferativas de Arabidopsis thaliana y zanahoria, la aplicación de 4 µM (0,92 mg · L) de BAP al medio de cultivo no tuvo efectos sobre la tasa de crecimiento celular; sin embargo, cuando la hormona se aplicó a niveles de 13 µM (2,98 mg · L) o 27 µM (6,2 mg · L) el crecimiento celular se redujo en un 30% y un 18% respectivamente, para el caso de las células de zanahoria. En A. thaliana la reducción del crecimiento celular se produjo sólo a concentración de 27 µM de BAP, siendo 39% menor que la del control. Estos resultados posiblemente podrían explicar el hecho de que las concentraciones más altas de BAP (13µM y 27 µM) produjeron fragmentación del ADN nuclear en las células de zanahoria, una etiqueta de muerte celular programada. Este mismo efecto fue observado en las células de A. thaliana tratadas con 27 µM de BAP. Pruebas adicionales para demostrar la apoptosis como la tinción con DAPI para probar la condensación localizada de la cromatina y la liberación de citocromo C en las fracciones mitocondriales y citosólicas dejaron en claro que altas concentraciones de BAP pueden inducir en las células de zanahoria y A. thaliana muerte celular programada, probablemente como resultado de aceleración de la senescencia de los tejidos (Carimi et al., 2003).
De otra parte, la adición de BAP a los medios de cultivo sin filtrado produjo la organogénesis de novo de brotes de vástagos después de seis semanas de la siembra, respuesta típica para esta clase de hormona. La mejor respuesta se observó con 1 mg · L con la cual se obtuvieron 3,55 brotes/explante. Esta concentración hormonal está de acuerdo con la reportada como la más adecuada para organogénesis a partir de segmentos foliares de tomate de árbol por Atkinson y Gardner (1993), quienes utilizaron 1 mg · L de BAP más 0,01 mg · L de NAA para obtener brotes de vástago a partir de segmentos de hoja y de pecíolos. La respuesta organogénica en el estudio de estos autores se presentó entre las cuatro y seis semanas de iniciado el cultivo. Obando y Jordan (2001) y Obando et al. (1992), establecieron que la mejor respuesta organogénica se obtuvo cuando los explantes foliares se sembraron sobre medio suplementado con TDZ en concentraciones de 5 a 10 mg · L, sin embargo para fines prácticos, la mejor opción es el BAP debido al menor costo de la fitohormona. Como en el caso anterior, la respuesta se obtuvo después de cuatro a cinco semanas de cultivo.
Un suceso inesperado en el presente estudio es el que cuando se utilizaron las combinaciones BAP 1 mg · L + F2x y BAP 1 mg · L + F4x, se observó la formación de callo friable y de color traslúcido o ligeramente café en los bordes de los explantes, hecho éste especialmente evidente en el último caso (Figura 2). Se consideran como puntos clave en el proceso organogénico ya que se ha demostrado que las heridas promuevan la actividad endógena de citocininas (Hare, Cress y Staden, 1997). Es bien conocido que la proporción citocinina a auxina determina el destino de las células sobre las cuales actúan; cuando la concentración de citocininas es mayor que la de las auxinas, la respuesta normalmente es la formación del vástago y cuando la relación es contraria se promueve la formación de novo de raíces.
Se ha demostrado recientemente que los hongos del género Colletotrichum son capaces de sintetizar la auxina ácido indolacético (AIA). Robinson, Riov y Sharon (1998) comprobaron que diferentes cepas de C. gloeosporioides f. sp. aeschynomene, C. coccodes, C. acutatum y C. lindemuthianum son capaces de biosintetizar AIA in vitro, en cantidades que varían entre 2 y 32 µg · mL de cultivo líquido. La tasa de síntesis del compuesto hormonal fue dependiente de la presencia y cantidad de triptofano adicionada a los medios de cultivo y también del tipo de medio de cultivo utilizado.
Chung et al. (2003) lograron los mismos resultados en un estudio con varias cepas de C. acutatum. Utilizando análisis cromatográficos y tinciones cromogénicas, identificaron en filtrados de cultivo del patógeno, AIA, triptofol (TOL), indol-acetaldehido, indol-acetamida (IAM), ácido indol-pirúvico, y ácido indol-láctico. Tomados juntos, estos estudios sugieren que los hongos del género Colletotrichum pueden sintetizar AIA a través de varias rutas y de manera dependiente de triptofano: la ruta del IAM y la ruta del ácido indol-pirúvico (Robinson, Riov y Sahron, 1998; Chung et al., 2003). La importancia de la producción de AIA en una interacción patogénica particular es que altas concentraciones de AIA pueden inhibir la respuesta hipersensible y pueden suprimir la expresión de genes de defensa vegetal (Maor et al., 2004).
Maor et al. (2004), demostraron además que C. gloeosporioides f. sp. aeschynomene es capaz de sintetizar AIA e IAM en la planta durante las fases biotrófica y necrotrófica de la infección de Aeschynomene virginica, siendo la producción más alta durante la primera fase. La tasa de biosíntesis fue de nuevo dependiente del suplemento de triptofano externo, probablemente obtenido a partir de los mismos tejidos de la planta infectada.
Siendo este el caso, es probable que las respuestas de formación de callo obtenidas en el presente estudio obedezcan a que el filtrado crudo utilizado contuviera algún nivel de AIA que al interactuar con el BAP produjera las respuestas observadas. Ensayos previos hechos en el mismo laboratorio,donde se realizó este trabajo, utilizando tiabendazole (TDZ) (0,4 mg · L) en lugar de BAP y con el mismo medio basal probaron que la adición de filtrado crudo en concentración relativa 2x y 4x a medios conteniendo TDZ producía después de un mes de cultivo, la formación de callo en el 66,67% y en el 82,86% de los explantes, respectivamente. El testigo sin filtrado produjo callo en el 40% de los explantes. Los porcentajes de formación de callo en los tratamientos correspondientes a la adición de BAP (2 mg · L) fueron 31,4%, 43,6% y 3,33% para los tratamientos con filtrado a concentración 2x, 4x y sin filtrado, respectivamente. En todos los casos, los callos obtenidos con los tratamientos con TDZ fueron muy superiores en tamaño a los correspondientes con BAP.
Orlando et al. (1997) encontraron que la adición de enzimas con actividad pectinasa (poligalacturonasa) provenientes de filtrados de cultivo de Rhizoctonia fragariae y Botrytis cinerea a un medio de cultivo para la regeneración de vástagos de frambuesa, produjo somaclones presumiblemente con base genética, que se mostraron resistentes a la enfermedad de la pudrición suave.
Dado que es reconocido que los oligosacáridos originados por la degradación de la pared celular pueden originar in planta respuestas de defensa. Orlando, Magro y Tugini (1997) plantean la posibilidad de que la selección in vitro con pectinasas produzca en las células del explante sometidas a la selección, un incremento en el contenido de fenoles con actividad antimicrobiana. Tal alteración del metabolismo podría tener además base genética la cual puede transmitirse a la progenie de las plantas regeneradas. De hecho, evaluaciones hechas in vivo por los mismos autores, muestran que las plantas regeneradas a partir de los somaclones y sus progenies fueron resistentes a la enfermedad cuando se asperjaron con esporas de B. cinerea. Igualmente, ensayos en los que se inocularon las raíces de las plantas control con micelio de R. fragariae mostraron síntomas distintivos tales como: vigor reducido y hojas con bordes marrón o completamente muertas, por el contrario, los somaclones regenerados de callos resistentes a las pectinasas mostraron una alta tolerancia a la enfermedad y crecieron casi tan normalmente como las plantas no tratadas (Orlando, Magro y Rugini, 1997).
En resumen, la metodología utilizada demostró su utilidad para la obtención y regeneración de plántulas de tomate de árbol con tolerancia a la acción del filtrado fitotóxico. Aquí se probó que la utilización de filtrados crudos de C. acutatum como agentes de selección in vitro para la obtención de material de tomate de árbol resistente o tolerante a la antracnosis es un método rápido, eficaz y seguro que permitiría la obtención de plantas con resistencia a enfermedades.
Ahmed, K. Z., Á.Mesterházy, T. Bartók, and F. Sági. 1996. In vitro techniques for selecting wheat (Triticum aestivum L.) for Fusarium-resistance. Part II. Culture filtrate technique and inheritance of Fusarium-resistance in the somaclones. Euphytica 91(3):341-349. [ Links ]
Atkinson, R. G. and R. C. Gardner.1993. Regeneration of transgenic tamarillo plants. Plant Cell Rpts. 12(6):347-351. [ Links ]
Carimi, F. M. Zottini, E. Formentin, M. Terzi, and L. Lo Schiavo. 2003. Cytokinins: new apoptotic inducers in plants. Planta. 216(#):413–421. [ Links ]
Chung, K. R. T. Shilts, U. Erturk, L.W. Timmer and P. Ueng, 2003. Indole derivates produced by the fungus Colletotrichum acutatum causing lime anthracnose and postbloom fruit drop of citrus. FEMS Microbiology Lett. 226:23-30. [ Links ]
Daub, M. E. 1986. Tissue culture and the selection of resistance to pathogens. Annu. Rev. Phytopathol. 24:159-186. [ Links ]
Fernando, T. H. P. S., C. K. Jayashinge and R.L.C. Wijesundera, 2001. Cell wall degrading enzyme secretion by Colletotrichum acutatum, the causative fungus of secondary leaf fall of Hevea brasiliensis. Mycol. Res. 105(2):195-201. [ Links ]
García-Pajón, C. M. and I. Collado. 2003. Secondary metabolites isolated from Colletotrichum species. Natural Prod. Rpts. 20(4):426-431. [ Links ]
Haberer, G. and J.J. Kieber. 2002. Cytokinins. New insights into a classic phytohormone. Plant Physiol. 128(2):354-362. [ Links ]
Hare, P. D., W. A. Cress and J. Van Staden. 1997. The involvement of cytokinins in plant responses to environmental stress. Plant Growth Regulat. 23(1-2):79–103 [ Links ]
Jayasankar, S., R. Litz, D.J. Cray and P. Moon. 1999. Responses of embriogenic mango cultures and seedlings bioassays to a partially purified phytotoxin produced by a mango leaf isolate of Colletotrichum gloeosporiodes Penz. In vitro Cellular Dev. Biol. Plant 35(6): 475-479. [ Links ]
Lobo, M. C. I. Medina y M. Cardona. 2000. Resistencia de campo a la antracnosis de los frutos (Colletotrichum gloeosporioides de tomate de árbol (Cyphomandra betacea, Solanum betaceum, Cav. Sendt). Rev. Fac. Nal. Agr. Medellin 53(2):1129-1142. [ Links ]
Madlung, A. and L. Comai. 2004. The effect of stress on genome regulation and structure. Ann Bot. 94(4):481-495. [ Links ]
Maor, R. S. Haskin, H. Levi-Kedmi and A. Sharon. 2004. In Planta Production of Indole-3-Acetic Acid by Colletotrichum gloeosporioides f. sp. aeschynomene. Appl. Environ. Microbiol. 70(3):1852-1854. [ Links ]
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473–497. [ Links ]
Obando, M. and M. Jordan . 2001. Regenerative responses of Cyphomandra betacea (Cav.) Sendt. (Tamarillo) cultivated in vitro. Acta Hort. (560):429-432. [ Links ]
Obando, M., A. Goreux y M. Jordan. 1992. Regeneración in vitro de Cyphomandra betacea (Tamarillo), una especie frutal andina. Cien. Invest. Agr. 19(3):125-130. [ Links ]
Orlando, R., P. Magro and E. Rugini. 1997. Pectic enzymes as a selective pressure tool for in vitro recovery of strawberry plants with fungal disease resistance. Plant Cell Rpts. 16(5):272-276. [ Links ]
Robinson, M., J. Riov, and A. Sharon. 1998. Indole-3-Acetic Acid Biosynthesis in Colletotrichum gloeosporioides f. sp. Aeschynomene. Appl. Environ. Microbiol. 64(12):5030–5032. [ Links ]
vânová, L. and Lebeda, A. 2005. In vitro selection for improved plant resistance to toxin-producing pathogens. J. Phytopathol. 53(1):52-64. [ Links ]
Villa Londoño, J. A. 1999. Cultivo del tomate de árbol. Politécnico Jaime Isaza Cadavid, Facultad de Ciencias y Tecnologías Aplicadas, Medellín, Colombia. 127 p. [ Links ]















