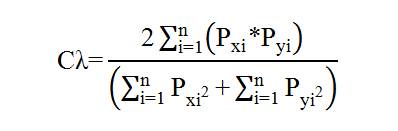Introducción
El conocimiento de la biología de los recursos pesqueros y los efectos de su explotación en los ecosistemas son insumos básicos de los procesos que buscan establecer medidas eficientes para su adecuada administración (Agudelo et al. 2011, Csirke 1989). En el mismo sentido, ese conocimiento puesto al alcance de los diferentes actores involucrados en el ordenamiento del uso de los recursos pesqueros, se convierte en una aproximación de manejo participativo (Puentes et al. 2015).
La importancia de los estudios de ecología trófica se debe a que la selectividad que ejercen los peces sobre su alimento y la variedad de hábitos, normalmente se relacionan con modificaciones en las condiciones ambientales o con los requerimientos energéticos. Estos, a su vez, explican cambios en el tamaño, tipo y cantidad de presas consumidas (Sánchez et al. 2013). De acuerdo con lo anterior, los estudios de hábitos alimenticios generan conocimientos fundamentales para comprender la variabilidad espacio-temporal de las poblaciones de peces a través de la información que resulta del estudio de sus presas (Sánchez et al. 2013).
Los Ariidos, familia a la que pertenece el barbudo de pluma Bagre marinus (Mitchill 1815), es uno de los grupos ícticos más abundantes en lagunas costeras y estuarios, en zonas tropicales y subtropicales del mundo, con bajas variaciones estacionales (Acero 2002, Betancur-R et al. 2007, Dantas et al. 2010, Marceniuk y Menezes 2007, Sánchez-Gil y Yáñez-Arancibia 1997, Yáñez-Arancibia y Lara-Domínguez 1988).
Bagre marinus se distribuye en el este del continente americano a lo largo del océano Atlántico, desde Estados Unidos hasta Brasil (Marceniuk y Menezes 2007). La talla de madurez sexual, según registros de estudios en México y Brasil (Caballero-Chávez 2013, Pinheiro et al. 2006), es aproximadamente de 40 cm de longitud total.
La dieta del B. marinus en ciertas áreas del Caribe, como la bahía de Cartagena en Colombia y el Golfo de México, se basa principalmente en algunos invertebrados bentónicos como crustáceos (camarones y cangrejos), moluscos (gasterópodos), material vegetal, detrito, insectos y peces, aunque en otros estudios predomina el material orgánico no identificado (MONI) (Acero 2002, Gunter 1945, Kobelkowsky y Castillo-Rivera 1995, Mendoza-Carranza 2003, Pardo-Rodríguez et al. 2003, Rudershausen y Locascio 2001, Yáñez-Arancibia y Lara-Domínguez 1988). Si bien este bagre es considerado un recurso de importancia pesquera, con potencial para su uso en la acuicultura, aún existen pocos estudios sobre su biología, a nivel mundial (Yáñez-Arancibia y Lara-Domínguez 1988), y ninguno en el golfo de Urabá.
Los estuarios poseen corredores importantes para la migración de los peces a lo largo de su desarrollo ontogénico, que son utilizados como áreas de crianza, reproducción, refugio y/o alimentación, debido a la gran abundancia de recursos alimenticios, la alta productividad y la heterogeneidad de sus ambientes (Canto-Maza y Vega-Cendejas 2007, Yáñez-Arancibia 1985). El golfo de Urabá por ser un gran estuario (Blanco 2011, García 2007) está compuesto de diferentes ambientes que albergan una gran variedad de organismos como los peces; estos juegan un papel muy importante en el proceso de transformación, conducción, intercambio, almacenamiento y regulación de nutrientes (Yáñez-Arancibia 1985, Yáñez-Arancibia et al. 2014).
El presente estudio se realizó como parte del proyecto Lineamientos Prioritarios para la Formulación de un Ordenamiento Pesquero del Golfo de Urabá - LOPEGU, el cual, ejecutado en el marco conceptual del manejo integrado costero, busca generar herramientas útiles para la adecuada gestión de los recursos pesqueros. El propósito del presente trabajo fue conocer los hábitos alimenticios del barbudo de pluma B. marinus (familia Ariidae), su variación espacio-temporal en el golfo de Urabá y determinar los cambios relacionados con su desarrollo. De manera similar a los trabajos de referencia en la Bahía de Cartagena y el Golfo de México hallamos en los contenidos estomacales peces, moluscos y crustáceos, los cuales caracterizamos en géneros y/o especies de presas y relacionamos con las características ambientales propias del golfo.
Materiales y métodos
Área de estudio
El golfo de Urabá, ubicado al sur del Caribe colombiano, se caracteriza por ser un cuerpo de agua semicerrado con 80 km de largo, entre 5,9 y 48,5 km de ancho y profundidades medias de 25 m y máximas de 80 m (Bernal et al. 2005, Escobar 2011, García 2007, Montoya y Toro 2006). La línea de costa del golfo de Urabá tiene una extensión de aproximadamente 609 km localizados entre Cabo Tiburón y Punta Arboletes (Correa et al. 2010). Es considerado el estuario de mayor tamaño en el Caribe colombiano, debido al gran aporte del río Atrato, el segundo río de mayor caudal en el país después del río Magdalena (García 2007).
El área de estudio presenta una temperatura superficial atmosférica media que fluctúa entre 26 °C y 28 °C (CORPOURABÁ 2003). La precipitación promedio anual es de 2.500 mm, y se presentan dos épocas climáticas definidas, la época seca (diciembre-abril) en la que predominan los vientos alisios del norte y noreste que confinan las aguas del río Atrato al interior del golfo, y la época de lluvias (agosto-noviembre) caracterizada por vientos de direcciones variables, que provocan que las aguas sean drenadas; es la época con mayores salinidades (Chevilliot et al. 1993, Montoya y Toro 2006). Los meses de junio y julio normalmente corresponden a un periodo de transición, fenómeno llamado veranillo de San Juan, característico de una distribución bimodal (Blanco y Castaño 2012, Chevilliot et al. 1993, García 2007, Ortiz y Blanco 2012).
La influencia de los vientos y de las mareas hace que en la columna de agua haya una interacción dinámica entre los aportes del mar Caribe, el río Atrato y la zona litoral, generando una circulación de tipo estuario, con aguas provenientes de los ríos en las capas superficiales y aguas de origen oceánico más saladas en las capas más profundas (Bernal et al. 2005, 2006). Además, se presenta una estratificación salina dada por el río Atrato, que genera una pluma salina estable, con un gradiente ambiental en gran parte del golfo de Urabá (Montoya y Toro 2006).
Diseño de muestreo
Las recolectas de especímenes de B. marinus se hicieron amparadas en el permiso marco No. 0524 del 27 de mayo de 2014, otorgado por la Autoridad Nacional de Licencias Ambientales (ANLA) y en el permiso No. 00001827 del 15 de octubre de 2015 de la Autoridad Nacional de Acuicultura y Pesca (AUNAP). Los individuos fueron recolectados entre agosto de 2015 y agosto de 2016, en seis salidas bimestrales de pesca experimental a bordo de una embarcación de pesca artesanal. Se seleccionaron diez puntos de muestreo ubicados a lo largo del golfo, los cuales fueron agrupados en dos grandes zonas: sur y norte (Figura 1). Se realizaron faenas diurnas y nocturnas empleando artes de pesca pasivas, como: palangre o tola (línea de nylon con 200 anzuelos de calibre número 12 y 14) y red de enmalle con diferentes tamaños de ojo de malla en pulgadas (23/4, 3, 4, 5 y 6). Los sitios de muestreo fueron establecidos en las principales zonas donde se concentran los caladeros de pesca determinados por la AUNAP, en jurisdicción del departamento de Antioquia (Figura 1).

Figura 1 Puntos de muestreos en el golfo de Urabá, ubicados en la parte norte (puntos 1-4) y sur (puntos 5-10) del golfo.
Los especímenes fueron sacrificados por exposición a una sobredosis de Eugenol (Rubio y Silveira 2009); posteriormente, el contenido estomacal se fijó, vía anal, con formaldehido al 4% para trasladar los individuos al laboratorio y realizar el análisis de la dieta. Se registró la longitud total en centímetros con un ictiómetro de 1 mm de precisión y se pesaron en gramos con una balanza electrónica de 0,01 mg de precisión (MyWeigh iBalance 5500). Para tener certeza en la identificación de la especie (B. marinus), se siguieron las claves taxonómicas de Acero (2002), Cervigón et al. (1992) y Robertson et al. (2015). Se depositó un ejemplar de B. marinus en el Museo de Historia Natural Marina de Colombia (MHNMC) del INVEMAR, con el código INV PEC9038.
En cada uno de los sitios de muestreo se midieron parámetros fisicoquímicos relacionados con el espectro trófico de la especie, tales como: temperatura, salinidad, conductividad, sólidos, pH y oxígeno disuelto (OD) (mg/L y %). Para ello se empleó un multiparámetro portátil (HANNA HI 98194). Además, se tomaron muestras de agua para determinar la concentración de seston y de clorofila como medidas indirectas de la productividad primaria y se midió la transparencia del agua en centímetros teniendo en cuenta la profundidad del disco Secchi.
Las presas encontradas en los estómagos fueron identificadas con ayuda de un microscopio estereoscópico con iluminación led (Motic SMZ 168T) hasta el menor nivel taxonómico posible, usando las claves para la determinación de especies de peces de Betancur-R y Acero (2005), Carpenter (2002), Cervigón et al. (1992) y Robertson et al. (2015); crustáceos de Cervigón et al. (1992) y moluscos de Díaz y Puyana (1994). Para la identificación de presas ícticas usando los otolitos se emplearon los catálogos Abilhoa y Correa (1993), Correa y Vianna (1993), Lemos et al. (1995a, 1995b), Rossi-Wongtschowski (2014) y Volpedo y Echeverria (1999, 2000); a su vez, se construyó una colección de referencia de otolitos de peces del golfo de Urabá. Además, se emplearon las metodologías de Hyslop (1980) y Marrero (1994) para estudios basados en dietas de peces. Se registraron las presas por conteo numérico (N), peso (P) y frecuencia de aparición (FA) y de acuerdo con su identificación, se clasificaron en diferentes categorías o grupos.
Análisis de datos
Descripción de la dieta. Se analizaron 373 estómagos en total, de los cuales 87 estaban vacíos y 34 contenían solo MONI. Para determinar si el tamaño de la muestra era suficiente para la descripción de la dieta de B. marinus, se realizó una curva de diversidad con los datos de abundancia de presas aplicando el Índice de Shannon-Wiener (1949); en esta curva, cuando la media acumulada llega a una asíntota, se alcanza un tamaño de la muestra apropiado para determinar la dieta del barbudo de pluma (Ferry et al. 1997).
Para estimar el coeficiente de vacuidad, se consideró el número de estómagos vacíos con respecto al total de estómagos (Windell 1971). El índice de repleción (IR) se calculó para estimar la condición de llenado de los estómagos (Hyslop 1980), teniendo en cuenta la escala propuesta por Franco y Bashirullah (1992): IR < 0,5 estómago semivacío, 0,5 < IR < 0,75 estómago semilleno, 0,75< IR = 1,0 estómagos llenos (IR = Peso del contenido estomacal/Peso total del pez x 100). Como indicador del gremio trófico de la especie estudiada, se estableció la relación de la longitud del intestino con la longitud total, siguiendo el criterio de Kappor (1975) que establece que los carnívoros tendrán una relación < 1, los omnívoros entre 2 y 5 y los herbívoros > 5.
Cada presa fue registrada por conteo numérico (%N = número de una presa / número de todas las presas x 100) (Bowen 1996, Hyslop 1980), porcentaje en peso (%P = peso de una presa / peso de todas las presas x 100) (Hynes 1950, Hyslop 1980, Bowen 1996) y frecuencia de aparición (%FA = FA de una presa / ∑ FA de todas las presas x 100) (Hyslop 1980), para el análisis y validación de la contribución en los hábitos alimenticios de B. marinus.
Se estimó el índice de importancia relativa (IIR = (% N + %P) * %FA) de los ítems alimenticios (Pinkas et al. 1970). Se calculó el índice de Levins (1968) que demuestra la amplitud del espectro trófico o nicho (Bi), el cual permite medir el nivel de especialización de los individuos, de modo que, si el valor se encuentra en un rango de 0 a 0,5 se considera al pez especialista, con un espectro de presas reducido y cuando el valor está en un rango de 0,6 a 1, su espectro es generalista.
Donde:
Bi = Índice de Levins para depredador i
P ij = Proporción de la dieta del depredador i que utiliza la presa j
n = número de categorías de las presas
Para evidenciar si la especie posee hábitos diurnos o nocturnos, se usó el índice de vacuidad de Windell (1971), luego de verificarse que los supuestos de normalidad y homogeneidad de varianza no se cumplieron. Se empleó la prueba U de Mann-Whitney (Mann y Whitney 1947) con el fin de comprobar la existencia de diferencias entre los dos periodos. Se utilizó el programa SPSS Statistics 24.0 (IBM), con significancia estadística igual o menor a 0,05.
Análisis temporal. Para determinar posibles diferencias entre épocas climáticas, se realizó una prueba de Mann-Whitney U, verificando los supuestos de normalidad y homogeneidad de varianza. Además, se estimaron los valores de Levins (Bi).
Análisis espacial. Para analizar posibles diferencias espaciales en la dieta entre los diez sitios muestreados a lo largo del golfo de Urabá, se calculó el índice de solapamiento trófico de Morisita-Horn (Horn 1966):
Donde:
Cλ = Índice de Morisita-Horn de traslapo.
n = Número total de presas.
P xi = Proporción de la presa i del total de presas usados en la zona x.
P yi = Proporción de la presa i del total de las presas usados en la zona y.
Se considera que existe un traslapo biológico cuando el valor excede de 0,60 (Langton 1982).
Para conocer la similitud de la dieta entre los sitios de muestreo, los datos de IIR se visualizaron gráficamente a través de un análisis de escalamiento multidimensional (MDS). Se calculó un valor de stress para obtener la bondad de ajuste de este método de ordenación, en el que mientras más se acerca a cero, mejor es la representación.
Finalmente, para relacionar la abundancia de las presas con el marco ambiental, se realizaron análisis de componentes principales (ACP), y de correspondencia canónica (ACC) con las variables descriptivas de los componentes del ACP, usando el paquete estadístico XLSTAT Premium
Análisis entre edades y sexos. Para evidenciar cambios ontogénicos en la dieta, se definió una estructura de tallas de los individuos colectados, estableciendo intervalos de clases aplicando la regla de Sturges (Daniel 1987), k = 1 + 3,322 (log10 n) y w= R /k; donde n es el número de individuos, k el número de intervalos, R el recorrido o rango (longitud mayor-longitud menor) y W la amplitud; clasificando a los individuos en cinco intervalos de tallas, con base en la longitud total (LT): Talla 1 (175-266 mm), Talla 2 (267-358 mm), Talla 3 (359-450 mm), Talla 4 (451-542 mm) y Talla 5 (543-634 mm). Para establecer las diferencias entre estas tallas, se usó el índice de traslapamiento trófico de Morisita-Horn (Horn 1966).
Para conocer posibles diferencias entre sexos, se utilizó la prueba Mann-Whitney U (Mann y Whitney 1947), debido a que no se cumplieron con los criterios de normalidad y homogeneidad de varianza. Se utilizó el programa SPSS Statistics 24.0 (IBM).
Resultados
Descripción de la dieta
El índice de vacuidad mostró que el 76,7% (286) de los estómagos contenían alimento, mientras que el índice de repleción gástrica estimó que el 34,9% de los estómagos se encontraban llenos, 21,4% en la categoría semi llenos y el 43,6 en la categoría semi vacíos. La curva de diversidad acumulada general de presas demostró que con 90 estómagos (Figura 2) se alcanza una asíntota, con lo cual se sustenta que la descripción de composición de la dieta de B. marinus es adecuada para este estudio con los 373 estómagos revisados.

Figura 2 Curva de diversidad (Shannon-Wiener, H’) de presas identificadas en la dieta de la población de Bagre marinus recolectados en los distintos caladeros de pesca (n = tamaño muestral óptimo).
Con respecto a diferencias entre día y noche, el índice de vacuidad demostró que el 77% de los estómagos de peces recolectados de día, y el 72% de aquellos recolectados de noche, contenían alimento; además, la prueba de Mann-Whitney U demostró que no hay diferencias significativas entre las dietas.
En total fueron identificados 41 ítems alimenticios en la dieta del barbudo de pluma B. marinus (Tabla 1), los cuales se dividieron en siete grandes grupos: Crustáceos, con la presencia de algunas especies de Penaeidae y Brachyura; Moluscos, con algunos Cephalopodos y Pyrgophorus sp. En el grupo de los peces se lograron identificar especies de las familias Engraulidae, Clupeidae, Ariidae, Carangidae, Sciaenidae y Trichiuridae. Los demás grupos fueron huevos de peces, material vegetal, MONI y otros, destacando la presencia de insectos y detritos. El ítem de mayor importancia fueron los restos de peces (%IIR: 43,089), seguido del pez Anchoa sp. (%IIR: 13,852), restos de crustáceos peneidos (%IIR: 13,063), el pez Cathorops mapale (%IIR: 8,270), huevos de peces (%IIR: 4,364) y material vegetal (%IIR: 2,571).
Tabla 1 Ítems alimenticios identificados para el barbudo de pluma Bagre marinus (%N= porcentaje del número de individuos; %P= porcentaje en peso; %V= porcentaje en volumen; %FA= porcentaje frecuencia de aparición; %I.I.R. = porcentaje del Índice de Importancia Relativa; en negrita ítems importantes) *Ítem más importante; **Materia Orgánica No Identificada
| Ítems alimenticios | %N | %P | %FA | %IIR |
|---|---|---|---|---|
| Crustáceos | ||||
| Gilvossius setimanus | 0,571 | 0,183 | 1,587 | 0,060 |
| Isopoda | 0,286 | 0,008 | 0,794 | 0,012 |
| Stomatopoda | 0,429 | 0,296 | 1,190 | 0,044 |
| Crustáceos Penaeidae | ||||
| Penaeus sp. | 2,000 | 1,667 | 4,365 | 0,808 |
| Xiphopenaeus kroyeri | 1,429 | 1,972 | 2,381 | 0,409 |
| Restos Penaeidae | 7,143 | 5,895 | 19,841 | 13,063 |
| Crustáceos Brachyura | ||||
| Aratus pisonii | 0,143 | 0,714 | 0,397 | 0,017 |
| Callinectes bocourti | 1,429 | 4,292 | 3,968 | 1,146 |
| Pachygrapsus gracilis | 0,143 | 0,081 | 0,397 | 0,004 |
| Epialtidae | 0,143 | 0,318 | 0,397 | 0,009 |
| Restos Brachyura | 2,429 | 2,482 | 6,746 | 1,673 |
| Total crustáceos | 16,143 | 17,908 | 42,063 | 17,246 |
| Moluscos | ||||
| Cephalopoda | 0,571 | 0,960 | 1,587 | 0,123 |
| Pyrgophorus sp. | 3,429 | 0,007 | 5,556 | 0,964 |
| Total moluscos | 4,000 | 0,967 | 7,143 | 1,086 |
| Peces | ||||
| Engraulidae | ||||
| Anchoa sp. | 32 | 4,381 | 7,540 | 13,852 |
| Centengraulis edentulus | 0,143 | 1,846 | 0,397 | 0,040 |
| Restos Engraulidae | 0,714 | 0,614 | 1,984 | 0,133 |
| Clupeidae | ||||
| Opisthonema oglinum | 1 | 10,237 | 2,778 | 1,576 |
| Ariidae | ||||
| Cathorops mapale | 4,571 | 11,302 | 10,317 | 8,270 |
| Restos Cathorops mapale | 2,571 | 10,021 | 7,143 | 4,542 |
| Restos Bagre marinus | 0,143 | 0,150 | 0,397 | 0,006 |
| Carangidae | ||||
| Caranx hippos | 0,143 | 0,353 | 0,397 | 0,010 |
| Chloroscombrus chrysurus | 0,429 | 2,295 | 0,794 | 0,109 |
| Restos Carangidae | 0,143 | 0,171 | 0,397 | 0,006 |
| Sciaenidae | ||||
| Larimus breviceps | 0,143 | 0,303 | 0,397 | 0,009 |
| Micropogonias furnieri | 0,143 | 0,680 | 0,397 | 0,016 |
| Stellifer stellifer | 0,143 | 0,343 | 0,397 | 0,010 |
| Stellifer venezuelae | 0,571 | 0,775 | 1,587 | 0,108 |
| Restos Isopisthus parvipinnis | 0,286 | 1,056 | 0,794 | 0,054 |
| Restos Larimus breviceps | 1,286 | 2,111 | 2,778 | 0,477 |
| Restos Micropogonias furnieri | 0,286 | 0,696 | 0,794 | 0,039 |
| Restos Stellifer venezuelae | 0,286 | 0,144 | 0,794 | 0,017 |
| Trichiuridae | ||||
| Trichiurus lepturus | 1,000 | 5,325 | 1,587 | 0,507 |
| Restos otros peces | 10,286 | 19,580 | 28,571 | 43,089 |
| Total peces* | 56,286 | 72,384 | 70,238 | 72,870 |
| Huevos de peces | 15,143 | 1,610 | 5,159 | 4,364 |
| Vegetal | 2,857 | 3,557 | 7,937 | 2,571 |
| MONI** | 1,714 | 0,367 | 4,762 | 0,500 |
| Otros | ||||
| Detrito | 1 | 1,390 | 2,778 | 0,335 |
| Insecta | 2,143 | 1,023 | 5,952 | 0,952 |
| Plástico | 0,429 | 0,699 | 1,190 | 0,068 |
| Restos Araneae | 0,143 | 0,004 | 0,397 | 0,003 |
| Restos ave | 0,143 | 0,091 | 0,397 | 0,005 |
| Total otros | 3,857 | 3,207 | 10,714 | 1,362 |
Análisis temporal
Entre las dos épocas climáticas existen diferencias significativas según la prueba de Mann-Whitney U (p = 0,013). Se destaca el consumo de engraulidos en la época seca; mientras que en la época lluviosa son más importantes los crustáceos, los restos de peces, los moluscos y los huevos de peces. Los valores del índice de Levins señalan a la especie, durante las dos épocas, como un consumidor especialista (lluvia, Bi=0,16; seca, Bi=0,03).
Análisis espacial de la dieta
Entre las zonas de estudio (norte y sur), no se presentaron solapamientos entre las dietas en la mayoría de los sitios muestreados (71% de las comparaciones presentan valores de Cλ < 0.6; Tabla 2). Sin embargo, el MDS mostró que en los sitios El Roto (zona sur) y Bajo del Medio (zona norte), las dietas tienen una similitud del 86,4% y hay un mayor consumo de presas como crustáceos braquiuros, peneidos, restos de peces, peces de la familia Sciaenidae (corvinas), peces ariidos de la especie Cathorops mapale, moluscos y la categoría otros ítems. Según ese mismo análisis, los sitios Yarumal (zona sur, costado oriental) y Leoncito (zona sur, costado oriental) también presentaron una alta similaridad (63,4%), con tendencia más marcada al consumo de presas como ariidos, restos de peces, crustáceos y moluscos. Las dietas en los sitios Punta Arenas Norte y Punta Arenas Sur, ambos en la zona norte, se parecen en un 71,6%, y presentan una tendencia a mayor consumo de crustáceos peneidos y restos de peces. En general, se observó que hay mayor similitud entre las dietas de los sitios localizados en una misma zona (norte o sur del golfo, excepto El Roto y Bajo del Medio) presentando una mayor tendencia al consumo de peces en los sitios del sur, mientras que en los del norte son más importantes los crustáceos (Figuras 3 y 4). En todos los sitios, la especie se puede catalogar como especialista (Tabla 3).
Tabla 2 Índice de Morisita-Horn (Horn, 1966) aplicado en los diferentes sitios de muestreo. En negrita si existe un solapamiento trófico. Zona norte: Bajo del Medio (BM), Punta Sabanilla (PS), Punta Arenas Norte (AN), Punta Arenas Sur (AS). Zona sur: Yarumal (YAR), Currulao (CUR), Leoncito (LEO), Isla Margarita (MARG), Candelaria (CAND), El Roto (ROT)
| BM | PS | AN | AS | YAR | CUR | LEO | MARG | CAND | ROT | |
| BM | x | 0,602567 | 0,746871 | 0,58979 | 0,76686 | 0,14449 | 0,53853 | 0,66042 | 0,52335 | 0,66487 |
| PS | x | 0,692116 | 0,54485 | 0,40775 | 0,05199 | 0,04881 | 0,18286 | 0,3327 | 0,54903 | |
| AN | x | 0,49612 | 0,56244 | 0,09986 | 0,31269 | 0,42784 | 0,4482 | 0,62415 | ||
| AS | x | 0,7014 | 0,14224 | 0,10388 | 0,26707 | 0,52699 | 0,63218 | |||
| YAR | x | 0,14217 | 0,55328 | 0,6649 | 0,54262 | 0,6048 | ||||
| CUR | x | 0,19644 | 0,19843 | 0,06832 | 0,08619 | |||||
| LEO | x | 0,90986 | 0,18209 | 0,12829 | ||||||
| MARG | x | 0,16131 | 0,26175 | |||||||
| CAND | x | 0,75542 | ||||||||
| ROT | x |
Las variables fisicoquímicas indican que existe un gradiente ambiental en toda el área de estudio marcado por la pluma del río Atrato con dirección sur-norte, en el que a medida que los sitios se alejan de los grandes afluentes, las condiciones son cada vez más marinas (Figura 5), como se observa en la temperatura, salinidad, transparencia, conductividad y sólidos suspendidos. El análisis de componentes principales (ACP) indica que los sólidos suspendidos, salinidad, conductividad, transparencia, pH, temperatura y DO (%) presentan una correlación positiva en el CP1 y una correlación negativa con DO (mg/L). Mientras para el CP2, DO (mg/L), DO (%) y temperatura correlacionan positivamente. Las medidas indirectas de productividad primaria, seston y clorofila, correlacionan de forma negativa con el resto de las variables (fisicoquímicos).

Figura 3 Ítems más importantes en la dieta de Bagre marinus en el golfo de Urabá (departamento de Antioquia), Colombia, según el porcentaje del Índice de Importancia Relativa (% IIR) especificado para cada caladero de pesca.
Tabla 3 Índice de Levins aplicado para los caladeros de pesca. Cuando un valor es cercano a cero se considera el pez como especialista y cuando el valor es cercano a uno, su espectro es generalista
| Levins | |
|---|---|
| Bajo del Medio | 0,187 |
| Punta Sabanilla | 0,216 |
| Punta Arenas Norte | 0,192 |
| Punta Arenas Sur | 0,250 |
| Punta Yarumal | 0,152 |
| Currulao | 0,034 |
| Leoncito | 0,043 |
| Isla Margarita | 0,070 |
| Bahía Candelaria | 0,208 |
| El Roto | 0,143 |
En el análisis de Correspondencia Canónica (ACC), se estableció que en el PC4 la temperatura y la salinidad presentan correlación positiva con los crustáceos Brachyura y Scianidae en los sitios con mayor influencia marina y parcialmente estuarina (parte norte del golfo de Urabá). Para el PC2 se observó que los ariidos, los huevos de peces y el material vegetal tienden a encontrarse en lugares con concentraciones altas de oxígeno (Leoncito y Margarita, presentes en el sector sur del golfo). Para este mismo sector, los engraulidos se relacionaron positivamente con la concentración de clorofila en el PC1. Las categorías MONI, moluscos y restos de peces, en los sitios de Currulao, El Roto, Candelaria y Yarumal, no presentaron correlación con ninguna de las variables, precisando el comportamiento estuarino de dichos lugares (Figura 6).
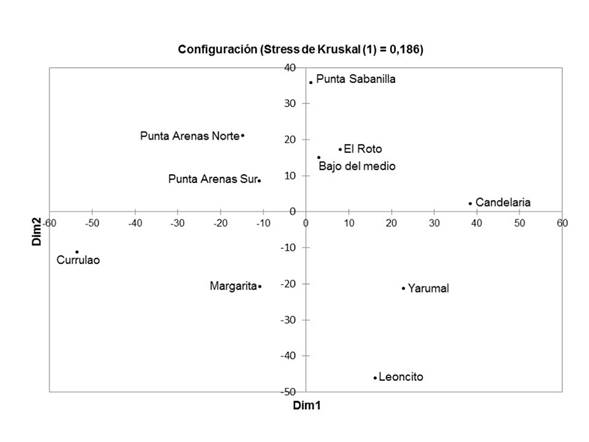
Figura 4 Análisis de escalamiento multidimensional (MDS) observando la similitud de la dieta, según el Índice de Importancia Relativa (IIR), de las presas consumidas entre los sitios de muestreo. Mayor proximidad en los sitios indica mayor similitud entre dieta. Se realizó aplicando el índice de disimilitud de distancia euclidiana.
Análisis entre tallas y sexos
En cuanto a la ontogenia, los valores del índice de Morisita-Horn (Horn 1966) evidencian un solapamiento únicamente entre las dietas de los peces de la talla 3 y la talla 4 (Cλ = 0,91; Tabla 4); entre el resto de las tallas la dieta es diferente significativamente. Se destaca en peces pequeños (talla 1) una mayor tendencia al consumo de crustáceos peneidos, mientras que las demás tallas consumen mayormente peces; la dieta de los individuos de la talla 2 presenta una mayor tendencia al consumo de restos de peces, especímenes de las tallas 3 y 4 consumen preferentemente C. mapale y engraulidos, y organismos de la talla 5 ingieren principalmente peces, específicamente de Opisthonema oglinum (Figura 7).
Existe diferencia significativa entre las dietas de los machos y las hembras según la prueba de Mann-Whitney U (p=0,005), pero se debe considerar que, en este estudio, el número de estómagos con alimento de hembras (214) fue significativamente mayor al de los machos (28).

Figura 5 Análisis de Componentes Principales (ACP) de las variables fisicoquímicas del agua, medidas en los diferentes caladeros de pesca en el golfo de Urabá (departamento de Antioquia), Colombia.

Figura 6 Análisis de correspondencia canónica (ACC) relacionando la abundancia de las presas en los estómagos con las variables ambientales.
Tabla 4 Índice de Morisita-Horn (Horn, 1966) aplicado a las diferentes tallas
| Talla 1 | Talla 2 | Talla 3 | Talla 4 | Talla 5 | |
| Talla 1 | x | 0,1713372 | 0,1609916 | 0,1838376 | 0 |
| Talla 2 | x | 0,4481403 | 0,4419186 | 0,0757847 | |
| Talla 3 | x | 0,9152656 | 0,1874561 | ||
| Talla 4 | x | 0,3091959 | |||
| Talla 5 | x |

Figura 7 Ítems más importantes en la dieta de Bagre marinus en el golfo de Urabá (departamento de Antioquia), Colombia, según el porcentaje del Índice de Importancia Relativa (% IIR), especificado en cada intervalo de talla, Talla 1 (175-266 mm); Talla 2 (267-358 mm); Talla 3 (359-450 mm); Talla 4 (451-542 mm) y Talla 5 (543-634 mm).
Discusión
La dieta del barbudo de pluma B. marinus se compone principalmente de peces y, en menor importancia, de crustáceos peneidos y braquiuros, lo cual es un resultado similar al de Pardo-Rodríguez et al. (2003) para la Bahía de Cartagena en Colombia y al de Gunter (1945), Kobelkowsky y Castillo-Rivera (1995), Mendoza-Carranza (2003), Rudershausen y Locascio (2001) y Yáñez-Arancibia y Lara-Domínguez (1988) en el Golfo de México.
A diferencia del estudio de Pardo-Rodríguez et al. (2003), en este estudio el material vegetal fue un ítem frecuente e importante. Con base en los resultados de la relación longitud del intestino/longitud total del organismo, es posible considerar que la especie es omnívora.
La relación longitud del intestino/longitud total del pez, en promedio fue de 2,01 que lo puede definir como un pez omnívoro (Figura 3), sin embargo, con base en los valores del índice de Levins, B. marinus puede ser considerado un depredador especialista (Bi=0,14). Cuatro de los estómagos provenientes de peces capturados en el sector de Currulao, contenían pedazos de material plástico (bolsas plásticas).
Especies pelágicas como los engraulidos, son considerados como unos de los principales transformadores de energía de fuentes primarias, que a su vez son aprovechados por consumidores de segundo orden como el barbudo de pluma. El presente estudio muestra que la Anchoa spp. es la presa más importante del barbudo de pluma en el sector de Currulao. Este sitio se caracteriza por altas concentraciones de clorofila, lo que implica una alta biomasa fitoplanctónica (Gómez et al. 2005), recurso alimentario que favorece a su vez a una alta abundancia de zooplancton que es el principal alimento de los engraulidos (Robertson et al. 2015).
Mediante los análisis de traslapamiento y las variables ambientales, se evidenció variación espacial de la dieta, que está relacionada con las diferencias en las condiciones ecológicas entre las distintas zonas. En la parte norte del sistema donde hay mayor frecuencia de crustáceos peneidos en la dieta, las salinidades altas y aguas profundas favorecen la abundancia de esos grupos que buscan esas condiciones para realizar su actividad reproductiva (Cortés 1991, Gunter et al. 1964). En contraste, los peces se convierten en un alimento importante en la zona sur, principalmente en los sitios que como el delta del río Atrato, abarcan grandes extensiones de manglar, hábitat del que se ha evidenciado que por sus características de poca transparencia y salinidad y alta productividad se convierte en sitio adecuado para el refugio, alimentación y reproducción de muchas especies de peces (Blaber 2000, Blanco et al. 2015, Dantas et al. 2012, Lara-Domínguez y Yáñez-Arancibia 1999, Nagelkerken et al. 2008, Yáñez-Arancibia et al. 1994, 2014), lo que explica la importancia de presas como los ariidos y los huevos de engraulidos en los estómagos de individuos capturados en esa zona. Es notable que la abundancia de huevos, larvas, juveniles y adultos de estas familias en esos ambientes del golfo ya se ha comprobado por otros estudios como el de Blanco et al. (2013), Correa y Palacio (2008), Correa et al. (2016), Leal-Flórez et al. (2017, comunicación personal), Sandoval (2012) y Sandoval et al. (2015).
En el desarrollo ontogénico de B. marinus se encontró diferencia en la composición de la dieta, debido a que esta puede cambiar con el crecimiento o por diferencias espacio-temporales (Pauly y Yáñez-Arancibia 1994, Yáñez-Arancibia et al. 1994, 2014). Se observó un marcado consumo de crustáceos peneidos (bentos) en los primeros estadios de crecimiento, principalmente en la zona Norte del golfo; mientras que los individuos de estadios más grandes se alimentaron en mayor medida de peces de las familias Engraulidae y Clupeidae (zona pelágica), cuyas abundancias eran mayores en la zona Sur del golfo. Estos resultados son similares a los encontrados por Sandoval et al. (2015) donde también se encontraron tendencias en los cambios ontogénicos de la dieta en otra especie de la familia Ariidae, Ariopsis sp.
Es indispensable seguir profundizando en el conocimiento de la biología y ecología de los otros recursos pesqueros, haciendo énfasis en aquellos de mayor importancia en términos de densidad y biomasa como el barbudo de pluma B. marinus. En este sentido los estudios de alimentación o dieta son fundamentales para entender el flujo de energía dentro de las redes tróficas y construir modelos necesarios para la toma de decisiones con base en un manejo ecosistémico de los recursos marinos (Dantas et al. 2010, Sánchez-Gil y Yáñez-Arancibia 1997).
En conclusión, B. marinus es un pez omnívoro con mayor tendencia a consumir peces como Anchoa spp. y Cathorops mapale y camarones peneidos como Penaeus spp. y Xiphopenaeus kroyeri. Los resultados respaldan la hipótesis planteada de tener una dieta basada en peces y crustáceos con diferencias en los géneros y/o especies de presas debido a las características ambientales propias del golfo. Se presentan cambios ontogénicos en la dieta, con tallas pequeñas (inmaduros) alimentándose de crustáceos e individuos de tallas grandes alimentándose de otros peces. De forma similar, se diferencian las dietas de los ejemplares capturados en la parte norte (dieta basada en crustáceos) y sur (dieta basada en peces) del golfo. Además, se pudo demostrar que la especie ajusta su dieta al gradiente estuarino en dirección sur-norte, con condiciones más marinas a medida que se va alejando de los grandes afluentes, lo que marca una diferencia en la disponibilidad de hábitats para sus presas más abundantes como crustáceos peneidos y peces.