INTRODUCCIÓN
La cuenca Magdalena está conformada por los ríos Magdalena y Cauca, actualmente en la cuenca Magdalena se registran 233 especies de peces, donde cerca el 68 % son endémicas (García-Alzate et al. 2020), muchas de ellas, especies de pequeño porte y con conformaciones corporales muy particulares, como las de los géneros Astroblepus y Trichomycterus. La riqueza de especies de peces en la cuenca está influenciada por patrones geomorfológicos y climáticos en el espectro altitudinal, la mayor riqueza de especies se reporta en las zonas bajas y tiende a reducirse hacia las zonas altas (Jaramillo-Villa et al. 2010, De La Barra et al. 2016), igualmente, existe un mayor recambio de especies (diversidad Beta) entre los sistemas en las zonas altas en comparación con las zonas bajas (Carvajal-Quintero et al. 2017, Herrera-Pérez et al. 2019). Si bien el número de especies se reduce con la elevación, el porcentaje de especies endémicas aumenta particularmente en las corrientes de cabecera (Anderson y Maldonado-Ocampo 2011). Esto puede verse influenciado por las altas pendientes ya que en las zonas con elevaciones altas los cuerpos de agua presentan valores entre los 35 a 45 grados de inclinación (Restrepo et al. 2006), ocasionando que los cuerpos de agua incrementen su velocidad, sean más turbulentos, oxigenados y de menor temperatura (Jacobsen 2008).
La formación de un embalse dentro de una cuenca genera cambios en los patrones de riqueza ya que se forma un nuevo sistema; el cual, además de aislar pequeños cuerpos de agua ubicados dentro de su área de influencia directa, configura nuevos ecosistemas. En la cuenca de los ríos Magdalena y Cauca, la mayoría de los embalses construidos antes del año 1990 para la generación de energía eléctrica, se ubican en los sectores alto y medio de la cuenca y arriba de los 700 m de elevación (Jiménez-Segura et al. 2014). En el río Porce, afluente del río Nechí (cuenca del río Cauca), se han formado varios embalses para generar energía eléctrica. En el río Grande, tributario del río Por-ce en su cuenca alta, se formó el complejo hidroeléctrico Quebradona-Riogrande II en el año 1950, situado entre los 2100 y 2300 m de elevación (Mazo-B et al. 2015). La cuenca tributaria del embalse está configurada por una extensa red de cauces de primer y segundo orden de los que no se conoce la ictiofauna que allí habita.
La investigación sobre la ictiofauna en embalses se ha enfocado en describir particularmente los cambios en la estructura del ensamblaje íctico en su eje longitudinal (Álvarez-Bustamante et al. 2018) y pocos se han dirigido a conocer la resiliencia en la estructura de la ictiofauna en los pequeños afluentes de alta montaña ante los cambios que suceden en el cauce, como las interrupciones en su flujo debido a la formación de embalses para generar energía eléctrica, la pérdida de bosque ripario debido al avance de la frontera agropecuaria y la presencia de especies de peces no nativas que son introducidas con fines pesqueros (Jiménez-Segura et al. 2014).
El objetivo de este trabajo es conocer el estado actual de los ensamblajes de peces en áreas altoandinas modificadas y proveer información sobre la respuesta de esas comunidades a los cambios en la cuenca. Esta investigación responde a las siguientes preguntas ¿Cómo cambian las características de la comunidad de peces entre los diferentes ecosistemas acuáticos presentes dentro del área de influencia de los embalses Quebradona y Riogrande II, en interacción con la temporalidad de sequía y lluvias?, ¿Qué tan similar es la composición de especies de peces entre ecosistemas acuáticos? ¿Cuáles variables ambientales están asociadas a la distribución de las especies en dos periodos climáticos? Este estudio provee conocimiento sobre la respuesta de la ictiofauna andina endémica ante la construcción de embalses, y aporta información complementaria para la toma de decisiones asociadas con la expansión de pequeñas centrales hidroeléctricas, donde se intervienen cursos de agua de pequeño orden dentro de la red fluvial Andina.
MATERIALES Y MÉTODOS
Área de estudio: Los embalses Quebradona y Riogrande II, se encuentran en la región montañosa de la cuenca de los ríos Magdalena y Cauca, a elevaciones de 2137 y 2267 m respectivamente (6°5o' Norte, -75°42' Oeste) (Fig. 1). Las temperaturas ambientales de la región oscilan entre doce y dieciocho grados Celsius, con una precipitación media anual de 1324 mm, la humedad alcanza promedios cercanos al 83 % entre los meses de octubre y noviembre (Mazo-B et al. 2015). En esta región se han identificado dos periodos lluviosos, uno entre abril y junio y otro, entre septiembre y noviembre (Suplemento 1). Las épocas de sequia son de diciembre a marzo y de julio a agosto, siendo la primera menos intensa que la segunda (Suplemento 1). El embalse Quebradona, capta el agua del río Grande, cuyo caudal promedio anual es de 34 m3/s. Este embalse con un volumen de almacenamiento de 500 000 m3, abastece la central de Mocorongo que tiene una capacidad instalada de 75 MW (Mazo-B et al. 2015). El embalse de Riogrande II presenta profundidades de 35 a 45 m, almacena 253 millones de m3 e inunda 1100 ha; tiene un tiempo medio de retención de 72,8 días y sus aguas turbias poseen una buena calidad química con sólidos disueltos máximos de 18 mg/l (Mazo-B et al. 2015).
Diseño de muestreo: Las muestras fueron tomadas en doce estaciones durante los meses de agosto (sequía) y octubre (lluvias) de 2020 (Suplemento 2). Para la toma de muestras en ríos y quebradas se seleccionó un tramo de 100 m a lo largo del cauce y en los embalses sobre la zona litoral. La conductividad eléctrica uS/cm, temperatura del agua °C, oxígeno disuelto mg/L, porcentaje de saturación de oxígeno, y el pH se registraron utilizando un multi-parámetro portátil (Hach HQ4üd; https://co.hach.com) y la transparencia del agua se midió utilizando un disco Secchi (Suplemento 2).
La captura de los peces se realizó entre las 08:00 y las 14:00 horas. Se usaron atarrayas con tamaño de malla de 0,5 cm, y 2 a 3 cm entre nudos y se realizaron 30 lances por sitio. Además, durante una hora se realizaron barridos con un equipo de pesca eléctrica con un amperio de corriente pulsante (340 V, 1-2 A, d.c.). Dentro de los embalses, se usaron redes estacionarias, cada una con 100 m de longitud y 3 m de alto. Cada red contó con diez aberturas diferentes de malla, desde uno hasta 10 cm de distancia entre nudos para aumentar la probabilidad de capturar individuos de diferentes tallas. En cada sitio dentro del embalse se colocaron tres redes, dos superficiales y una a ~4 m de profundidad durante seis horas. Adicionalmente durante seis horas se usó una trampa para peces de malla plegable cilíndrica de 40 cm de diámetro y 4 m de largo y una línea de 20 anzuelos de 40 m de longitud, donde los anzuelos se encontraban separados cada 2 m y a 1,5 m de profundidad. Adicionalmente, se realizó registro fotográfico de cada especie capturada. La clasificación de especies siguió a Van der Laan et al. (c2021) y la lista de peces de Colombia (DoNascimiento et al. 2020); para la identificación se emplearon claves taxonómicas especializadas tales como Maldonado-Ocampo et al. (2005), Román-Valencia y Ar-cila-Mesa (2010) y Lasso et al. (2020). Representantes de cada especie fueron depositados en la colección ictiológica de la Universidad de Antioquia (CIUA 168); los ejemplares que no se sacrificaron fueron liberados.
Análisis de datos: Para responder la pregunta ¿Cómo cambian las características que describen la comunidad de peces, en el área de influencia de los embalses Quebradona y Riogrande II, en el transcurso de un periodo de sequía y de lluvia? Se contaron los peces y se estimó la abundancia de cada especie por sitio de muestreo. Para determinar diferencias en la abundancia de peces entre sistemas acuáticos (embalses, ríos, quebradas) se realizó la prueba no paramétrica Kruskal-Wallis (P < 0,05; nivel de confianza 95 %) (Zar 2007). Para determinar diferencias en la abundancia entre lluvias y sequía se realizó la prueba no para-métrica de Wilcoxon (P < 0,05; nivel de confianza 95 %) (Zar 2007). Estas pruebas se realizaron dado que los datos no cumplieron con los supuestos de normalidad de varian-zas. Se utilizó el paquete ggpubr (Kassambara c2018), en el software R (versión 3.6.3).
Para estimar la diversidad de especies de peces de cada sistema acuático y por periodo climático se utilizaron curvas de interpolación (rarefacción)/extrapolación basadas en los tres primeros números de la serie de Hill (1973) y siguiendo el método propuesto por Jost (2006) y Chao et al. (2014). Posteriormente, se construyeron las curvas de interpolación (rarefacción)/extrapolación con relación al número de individuos capturados, con un intervalo de confianza construido mediante el método de remuestreo bootstrap para 0D, 1D, y 2D, usando el paquete iNEXT (Hsieh et al. 2016), en el software R (versión 3.6.3). Cuando la curva de extrapolación alcanza la asíntota, permite estimar la proporción de especies que el muestreo actual logró registrar con respecto a una riqueza total potencial indicada por la asíntota, donde valores cercanos a uno señalan un muestreo robusto de la diversidad (Chao et al. 2014).
Para responder la pregunta ¿Qué tan similar es la composición de especies entre ecosistemas acuáticos? Se utilizó el método de ordenación indirecta de gradiente (análisis de correspondencia sin tendencia, ACD) discriminando por el periodo hidrológico. Se utilizó el software CANOCO versión 4.5 (Ter Braak y Smilauer 2002).
Para determinar ¿Cuáles variables ambientales están asociadas a la distribución de las especies en ambos periodos climáticos? realizamos un Análisis de Componentes Principales -ACP, utilizando el conjunto de datos que contiene la descripción de las características del hábitat y las características fisicoquímicas del cuerpo de agua en cada sitio de muestreo; las variables fueron centradas y escaladas previamente. Finalmente, se representa la abundancia de cada especie dentro del gradiente de cada variable identificada por el ACP; este análisis se realizó utilizando la función dudi.pca del paquete ade4 (Thioulouse y Dray 2007), en el software R (versión 3.6.3).
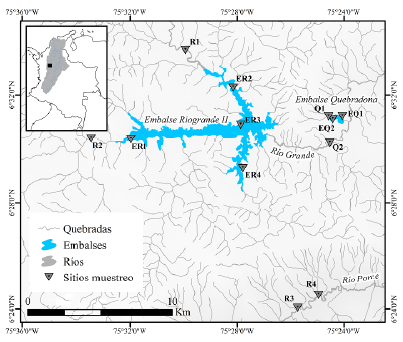
Figura 1 Sitios de muestreo en los embalses Quebradona y Riogrande II. La cuenca Magdalena se presenta en el recuadro superior izquierdo. Los perfiles de ríos, quebradas, embalses y cuencas se obtuvieron del IGAC (https://geoportal.igac.gov.co/).
RESULTADOS
Diversidad de peces en el área de influencia de los embalses. Se capturó un total de 420 individuos (n sequía = 302; n lluvias = 118), representantes de siete especies, seis familias y seis órdenes (Tabla 1; Suplemento 3). Cuatro especies no son nativas de la cuenca: la carpa común Cyprinus carpio, el guppy Poecilia reticulata, la trucha bass Micropterus salmoides y la trucha arcoíris Oncorhynchus mykiss.
Tabla 1 Número de individuos por especie capturados en los muestreos realizados en temporadas de sequía y lluvias en el 2020, para cada sistema acuático (embalses, quebradas, ríos) (códigos sitios según suplemento 1). (*) Especies no nativas de la cuenca Magdalena-Cauca.
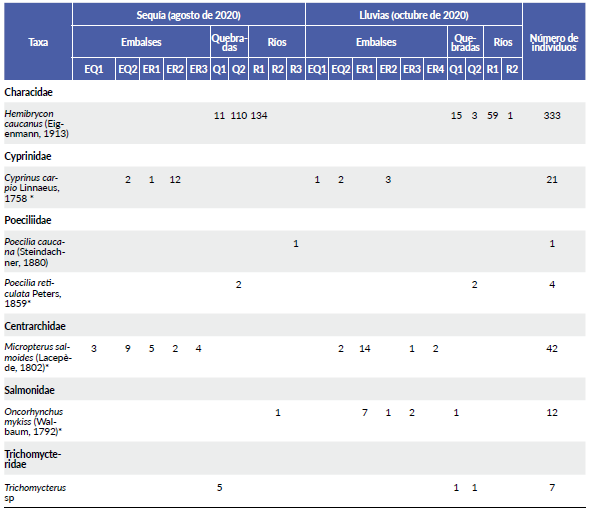
Para ambos periodos hidrológicos las especies de las familias Characidae y Centrarchidae fueron los de mayor abundancia (Tabla 1), mientras que, las especies de las familias Trichomycteridae, Poeciliidae y Salmonidae fueron menos abundantes (< 5 % de las capturas, Tabla 1). En sequía, la especie de mayor abundancia fue Hemibrycon caucanus (n =255; 85 %) seguida de las especies M. salmoides (n = 23; 7,6 %) y C. carpio (n = 15; 5 %). En tanto que las menos abundantes fueron O. mykiss, Poecilia caucana, P. reticulata y Trichomycterus sp. (Tabla 1). En lluvias, la especie más abundante fue H. caucanus (n =78; 66,1 %), seguida de M. salmoides (n =19; 16,1 %). Siendo las menos abundantes C. carpio, P. reticulata y Trichomycterus sp. (Tabla 1).
En el periodo de sequía, las mayores capturas se registraron en los sitios dentro del río (n = 136), seguido de aquellos dentro de las quebradas (n = 128) y en menor número en los sitios de los embalses (n = 38) (Tabla 1). En lluvias, las mayores capturas también se registraron en los sitios dentro del río (n = 60), seguidas por aquellos dentro de los embalses (n = 35) y en menor número en los sitios de quebradas (n = 23) (Tabla 1). No se detectaron diferencias significativas de las abundancias entre los sistemas acuáticos (Kruskal-Wallis H: 0,14; P > 0,05) y entre la temporalidad climática (Wilcoxon, P > 0,05) (Suplemento 4).
La riqueza de peces y el número efectivo de especies de orden q = 0 fueron mayores en los sitios de quebradas y ríos, y menores en los sitios de embalses (Fig. 2; Suplemento 5). Por su parte, los números efectivos de especies comunes (orden q = 1) y dominantes (orden q = 2) además de similares en las quebradas y ríos fueron menores que en el sistema de embalses (Fig. 2; Suplemento 5). No se observan diferencias de los valores de diversidad entre los periodos climáticos con un intervalo de confianza estadístico del 95 %. Los valores de la representatividad de los muestreos fueron similares entre los ecosistemas y en ambas temporalidades, superando el 96 % de similitud (Fig. 2; Suplemento 5).
Distribución de las especies en sistemas altoandinos. En el periodo climático de sequía el análisis espacial dentro de los embalses, ríos y quebradas, arrojó una longitud de gradiente de 3,7 del ACD y este explicó el 36,6 % de la variabilidad acumulada (Fig. 3). Se observó que en los sitios de embalses se distribuyeron especies como C. carpio y M. salmoides dominando en el ensamblaje; mientras que en quebradas y ríos el ensamblaje estuvo conformado por las especies H. caucanus, O. mykiss, P. caucana, P. reticulata, y Trichomycterus sp. (Fig. 3). En el periodo de lluvias el análisis espacial dentro de los embalses, ríos y quebradas, arrojó una longitud de gradiente de 2,1 del ACD y este explicó el 62,1 % de la variabilidad acumulada (Fig. 3). En los embalses se distribuyen especies como M. salmoides y C. carpio dominando el ensamblaje de peces. Mientras que en las quebradas y ríos el ensamblaje estuvo conformado de forma similar al del periodo de sequía, representado por las especies Trichomycterus sp., P. reticulata y H. caucanus (Fig. 3). En este periodo O. mykiss se encontró en condiciones ambientales intermedias entre sistemas de embalses y quebradas.
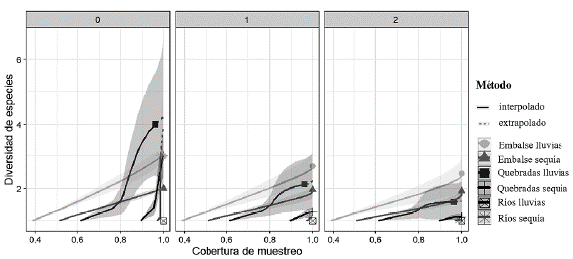
Figura 2 Curvas de interpolación (rarefacción)/extrapolación basadas en los tres primeros números de la serie de Hill (q 0, 1, 2) según la cobertura de muestreo, de quebradas, ríos y embalses en el monitoreo de sequía y lluvias.
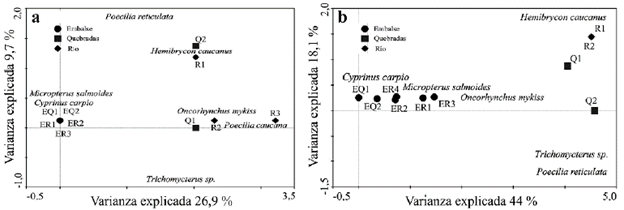
Figura 3 Proyección gráfica del ACD donde se indican similitudes en la composición del ensamblaje entre los sistemas acuáticos y según el periodo climático. a sequía, b lluvias.
Relación entre las variables ambientales y la distribución de peces. El ACP muestra que las dos primeras componentes principales explican 85,2 % de la varianza total (Fig. 4). Para el sistema de embalse se observa que variables como el oxígeno disuelto, el porcentaje de saturación de oxígeno, la transparencia, el pH y la temperatura, se asocian a la distribución de las especies no nativas. De igual forma se observa una tendencia agrupadora en el ensamblaje de peces presentes en el río, constituido principalmente por las especies O. mykiss y P. caucana con la conductividad. Mientras que en el sistema de quebradas se observa que las variables que se asocian a la distribución de estas especies son similares a las observadas en los sistemas de embalse y río, lo que indica que otras características se relacionan con la distribución de las especies de los géneros Hemi-brycon y Trichomycterus (Fig. 4). El análisis no identifica asociaciones entre los periodos climáticos, las variables ambientales y la distribución de las especies de peces en el área de influencia de estos embalses (Suplemento 6).
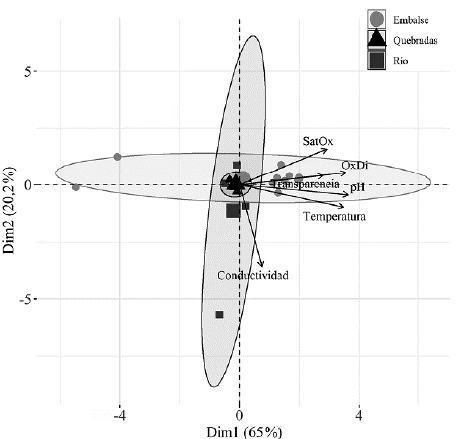
Figura 4 Análisis de Componentes Principales de los en samblajes de especies y variables ambientales agrupado por sistema acuático: Embalse, Quebradas, Río. Porcentaje de Saturación de Oxígeno (%) (SatOx), Oxígeno disuelto (mg / L) OxDi, Conductividad (μS / cm), pH, Temperatura (°C) y Transparencia.
DISCUSIÓN
Ensamblaje de peces en embalses altoandinos. La fauna íctica del área de influencia de los embalses Quebradona y Riogrande II está conformada por siete especies, cuatro de ellas no nativas de la cuenca Magdalena (Lasso et al. 2020). Las especies nativas capturadas representan el 1,3 % de las reportadas para la cuenca (DoNascimiento et al. 2020). Por tratarse de una zona de alta montaña, el número de especies capturadas fue bajo, sin embargo, estos resultados son los esperados ya que el intervalo de elevación es un factor determinante de la riqueza de peces en la cuenca del Magdalena (Jaramillo-Villa et al. 2010, Herrera-Pérez et al. 2019).
Por otra parte, en los sistemas de ríos y quebradas fue donde se capturaron el mayor número de especies, siendo las de los géneros Hemibrycon, Trichomycterus, Poecilia y O. mykiss las más frecuentes. Por su parte, en los embalses las especies dominantes fueron M. salmoides y C. carpio, ambas no nativas. Estos resultados concuerdan con las exploraciones que se han llevado a cabo en otros sistemas embalsados en los andes colombianos, donde se registra un mayor número de especies en los sistemas de quebradas y ríos, y en los embalses dominan las especies no nativas (Londoño et al. 2019, Valencia-Rodríguez et al. 2020, Valencia-Rodríguez et al. 2021).
En los sistemas acuáticos de flujo libre de los Andes la llegada de las lluvias influye en el cambio en el ensamblaje de peces, donde, la diversidad y abundancia son mayores en la época de bajo caudal o sequía, debido a la menor amplitud del cauce y disminución de la profundidad, mientras que la época de alto caudal o lluvias trae consigo un aumento de la amplitud del lecho incrementando la dispersión de los ensamblajes, por ende las capturas y registro de las especies de peces son menores (Jiménez-Segura et al. 2016a). Sin embargo, para los embalses Quebradona y Riogrande II se identificó que no hay diferencias de la diversidad y abundancias de los ensamblajes según el periodo climático, resultados que concuerdan con aquellas presas construidas en cascada en los Andes y el Neotrópico (Pompeu y Godinho 2006, Agostinho et al. 2008, Álvarez-Bustamante et al. 2018).
La distribución del ensamblaje de especies de peces es diferente entre los sistemas acuáticos evaluados, pero no presenta variación temporal. Las condiciones lacustres de los embalses de Quebradona y Riogrande II, y la elevación a la cual fueron construidos favorecen la presencia de dos especies no nativas M. salmoides y C. carpio, las cuales tienen varios rasgos de sus estrategias de vida como su amplia tolerancia ambiental, alta fecundidad, la alta tasa de crecimiento y una dieta generalista, lo cual las hace particularmente exitosas como especies invasoras (Schade y Bonar 2005). Mientras que en los ambientes de quebradas y ríos se distribuyen principalmente las especies H. caucanus, Trichomycterus sp., y las especies no nativas O. mykiss y P. reticulata cuya morfología les permite remontar corrientes, y habitar en la columna de agua de estos sistemas (Maldonado-Ocampo et al. 2005, Jiménez-Segura et al. 2016a). Es de resaltar la presencia de O. mykiss en los sistemas de quebradas en sequía, y en los sistemas de embalses en lluvias, demostrando una amplia tolerancia ambiental, y donde aún no es claro el efecto de esta especie sobre la fauna nativa en la zona, aunque diversos trabajos indican disminución en la biodiversidad en sistemas acuáticos donde ha sido introducida (Crawford y Muir 2008).
Para estos sistemas altoandinos se observa que las variables ambientales estuvieron asociadas con la distribución de las especies según los sistemas acuáticos. En los embalses la penetración de la luz, la temperatura, el oxígeno, y el pH, se asocian con la distribución de M. salmoides y C. carpio. Por otra parte, la conductividad del agua está asociada con la distribución de las especies P. caucana y O. mykiss en los sistemas de quebradas y río, ambas especies reportadas en diversas características ambientales de sistemas de flujo en la cuenca Magdalena (Maldonado-Ocampo et al. 2005, Crawford y Muir 2008). En cuanto a las especies H. caucanus, Trichomycterus sp. y P. reticu-lata que se distribuyeron en las quebradas, no se observó relación con las variables ambientales medidas, y tal vez otras variables están asociadas a su distribución. Para estas especies en sistemas acuáticos de la cuenca del Magdalena se ha reportado que variables tales como la conformación del sustrato en el lecho del cauce y el bosque ribereño, son importantes para su distribución (Montoya-Ospina et al. 2018).
Perspectivas para la conservación. Los embalses ubicados en los Andes alteran las condiciones naturales de los sistemas como el régimen de flujo, la retención de sedimentos en el embalse y la restructuración de las comunidades acuáticas (Jiménez-Segura et al. 2014). La mayoría de las especies de peces nativas no tienen las condiciones fisiológicas, morfológicas y comportamentales para permanecer en estos sistemas acuáticos modificados (Agostinho et al. 2008, Carvajal-Quintero et al. 2017). Lo que sucesivamente lleva a un declive de su abundancia y riqueza, y favorece el establecimiento de especies no nativas que han sido introducidas para el fomento pesquero (Jiménez-Segura et al. 2014). Se ha documentado que la introducción de las especies de peces no nativas en la cuenca Magdalena es cada vez más reconocida como un importante contribuyente a la amenaza de extinción de especies y degradación de ecosistemas acuáticos (Jiménez-Segura et al. 2016b). Para esta cuenca son escasas o nulas las investigaciones sobre el efecto de la permanencia de estas especies (Barletta et al. 2010). Se han planteado hipótesis de su interacción con especies nativas, y se les atribuye competencia por espacio, reproducción y refugio con las especies nativas (Gozlan et al. 2010, Cucherousset y Olden 2011). Esta situación aumenta el interés de conocer los aspectos ecológicos de las diferentes especies de peces que convergen en el área de influencia de las centrales hidroeléctricas, permitiendo así, proponer recomendaciones y oportunidades para la conservación y manejo de estas especies en los sistemas acuáticos de los Andes de Colombia.















