Introducción
El almidón es un polisacárido compuesto por unidades de glucosa unidas principalmente por enlaces glicosídicos a-1,4. Sus formas más simples son un polímero de menor peso molecular denominado amilosa y un polímero ramificado denominado amilopectina (Magallanes-Cruz, et al., 2017). Es el mayor polímero de reserva energética de las plantas, en cuyas raíces, semillas y frutos se almacena en forma de gránulos. Este polisacárido se encuentra en cereales como el arroz, el trigo y el maíz y en tubérculos como la papa, la yuca y la patata dulce (Bertoft, 2017).
Industrialmente el almidón es degradado hasta glucosa por hidrólisis química o enzimática para obtener principalmente jarabes que producen etanol mediante procesos de fermentación microbiana (Quintero, et al., 2010).
Las amilasas son las principales enzimas extracelulares que hidrolizan el almidón al degradarlo en unidades de sacáridos de menor peso molecular (Robyt, 1984). Además de ser utilizadas para obtener jarabes, las amilasas tienen una amplia aplicación en las áreas farmacéutica, cosmética y alimenticia, en la remoción o degradación de contaminantes de la industria textil y del papel y en la producción de detergentes enzimáticos, representando comercialmente el 25 % del mercado mundial de enzimas (Nigam & Singh, 1995; Turner, et al., 2007; Yildirim-Akatin, 2019).
Las amilasas tienen diversos orígenes, sin embargo, las más utilizadas son las de origen microbiano, las cuales se producen a partir de bacterias y hongos de los géneros Bacillus sp. y Aspergillus sp., respectivamente. Las especies del género Bacillus (B. subtilis, B. stearothermophilus, B. macerans, B. megaterium y B. amyloliquefaciens) se han reportado como aquellas con los mejores rendimientos en la producción de amilasas usando medios de cultivo de fermentación líquida o sumergida, que son los más utilizados en la produc ción industrial de enzimas amilolíticas (El Enhasy, 2007).
En Colombia existen regiones en las que la producción de papa (Solanum tuberosum L) es la principal fuente de ingresos por la diversidad de variedades que pueden culti varse (Lizarazo, et al., 2015) y, aunque los residuos de los cultivos tanto después de la cosecha como en el procesamiento, se han utilizado principalmente para la alimentación animal, recientemente han comenzado a aprovecharse en la producción de glicerol y de ácido láctico (Peñaranda, et al., 2017). Sin embargo, se estima que alrededor de un cuarto de los residuos de papa generados durante su procesamiento industrial son descartados (Romo, et al., 2019). Además, los residuos agroindustriales con un contenido considerable de almidón se usan como una fuente de carbono de bajo costo para la biosíntesis de amilasas (Abd-Elhalem, et al., 2015), por lo que las cáscaras de papa podrían ser una materia prima importante para su obtención, lo cual contribuiría, asimismo, a la mitigación del impacto ambiental de este tipo de desechos y disminuiría los costos de producción por ser una alternativa viable y de bajo costo para la producción de estas enzimas.
El objetivo de este trabajo fue evaluar la producción de amilasas a partir de residuos de cáscaras de papa en fermentación sumergida con pH de 5,0, 7,0 y 8,0 usando una cepa de B. amyloliquefaciens (A16) previamente aislada de suelos de humedales de Bogotá. Este es el primer estudio reportado sobre la obtención de amilasas con estas condiciones. Se estimó su producción en los extractos enzimáticos mediante ensayos cuantitativos que permitieron determinar la concentración residual de almidón y la actividad enzimática (U/mL) determinada como la cantidad de enzima que produce un umol de azúcar reductor por minuto y por mililitro (Haq, et al., 2003; Karnwal & Nigam, 2013; Abd-Elhalem, et al., 2015).
Materiales y métodos
Tratamiento previo de los residuos de cáscaras de papa
Los residuos de cáscaras de papa (S. tuberosum L) provenían de restaurantes ubicados en la zona industrial de la localidad de Puente Aranda en Bogotá y se recolectaron directamente de los centros de acopio de estos negocios sin seleccionarlos según la variedad específica de tubérculo.
Los residuos se lavaron con agua potable para eliminar otros residuos adheridos, se les adicionaron 10 mL de éter etílico para extraer las grasas y, posteriormente, se eliminaron los azúcares reductores con 10 mL de etanol al 80 %. Los residuos se cortaron en trozos de aproximadamente 1 cm2, se deshidrataron en una cámara de calor (Binder - Fed 115) a 70 °C hasta obtener un peso seco constante y, por último, se conservaron a -80 °C para preservarlos hasta su utilización.
Caracterización de los residuos de papa
Los residuos deshidratados y congelados a -80 °C se pasaron directamente a la cámara de calor a 70 °C durante una hora, con el fin de eliminar el agua resultante del proceso de descongelación, y para caracterizarlos; cada ensayo se hizo por triplicado. Para determinar la humedad se llevaron 2 g de residuos sin tratamiento previo a la cámara de calor a 103 °C hasta el punto de peso seco constante, posteriormente se cuantificó el contenido de agua mediante gravimetría y una vez determinada su humedad, los residuos se calcinaron en una mufla (Thermolyne™) a 550 °C hasta el punto de peso constante para determinar el contenido de cenizas (Masson, 1994).
La cuantificación del almidón de las cáscaras de papa, previamente tratadas para eliminar la glucosa residual, se hizo de manera indirecta titulando la glucosa producida luego de la hidrólisis ácida del almidón presente en 1,0 g de residuos de papa y en 1,0 g de almidón hidrosoluble (Merck), en tanto que el contenido de almidón de los residuos se calculó comparando los títulos de Fehling obtenidos. En la titulación se empleó reactivo de Fehling previamente estandarizado con solución de glucosa (Fisher) al 0,5 % p/v (Gerena-Baron, 2013).
La concentración de calcio y magnesio se determinó en 5,0 g de residuos previa mente tratados y calcinados a 550 °C en una mufla Thermolyne™ hasta el punto de peso constante; se tomaron 0,5 g del producto de la calcinación y se trataron con solución de ácido nítrico (Merck) al 65 %. La cantidad de calcio y magnesio en la solución preparada se determinó en un equipo de absorción atómica (Shimadzu - AA7000). Para la determinación del calcio se utilizó una curva de calibración entre 0,01 y 0,04 mg Ca/L preparada a partir de una solución de calcio estándar (Merck), y como blanco se utilizó una solución de 0,25 % de cloruro de potasio (Merck), 0,65 % de ácido nítrico (Merck) y 0,05 % de lantano (Sigma). Para cuantificar el magnesio se preparó una curva entre 0,1 y 0,4 mg Mg/L a partir de una solución de magnesio estándar (Merck), empleando como blanco una solución de 0,65 % de ácido nítrico y 0,04 % de cloruro de estroncio (Merck) (Masson, 1994; Londoño-Posso, 2013).
Para determinar el nitrógeno total se llevaron 10 g de cáscaras previamente tratadas y maceradas a un digestor Kjedahl (FOSS Kjeltec™ 8200). Finalizada la digestión, la muestra se sometió a retrotitulación con una solución de 0,05 M de ácido clorhídrico (Merck) (Masson, 1994).
Los fosfatos se determinaron por el método colorimétrico de amarillo de molibdovanadato en un espectrofotómetro (Shimadzu UV - 1800) a partir de 1,0 g de residuos calcinados utilizando una curva de calibración entre 2,4 y 12 mg (PO4)3/L a partir de dihidrogenofosfato de potasio (Fisher) y como blanco, una solución de 0,5 % de molibdato de vanadio (Merck), 0,00125 % de vanadato de amonio (Merck) y 2,5 % de ácido nítrico (Merck) (Masson, 1994).
Preparación de medios de cultivo
Se añadieron 23,5 g de cáscaras de papa deshidratadas y maceradas en un matraz de Erlenmeyers de 250 mL y se esterilizaron a 121 °C y 15 psi durante 20 minutos. Posteriormente se mezclaron con 0,23 g/L de solución de cloruro de calcio (Merck) esterilizada con filtro de 0,22 μm para un volumen final de 150 mL y una concentración de almidón de 0,15 % p/v. El pH del medio se ajustó a 5, 7 y 8 con una solución de 0,1 M de ácido clorhídrico o hidróxido de sodio esterilizada por filtración.
Se prepararon cuatro medios de control con caldo de almidón al 1 % p/v (0,25 g de extracto de levadura, Scharlau), 0,25 g de peptona, 0,1g de sulfato de magnesio, 0,01 g de cloruro de calcio, 0,01 g de fosfato de potasio monobásico y 0,01 de fosfato de potasio dibásico. Un medio se ajustó a un pH de 5,0, dos a 7,0 y uno a 8,0.
Producción de amilasas
Se reactivó una cepa de B. amyloliquefaciens (A16) previamente aislada de suelos de humedales de Bogotá y conservada a -80 °C (Buitrago, et al., 2014) en 100 mL de caldo nutritivo (OxoidTM) a 37 °C durante 24 horas. Una vez reactivada la cepa, se tomaron 10 mL, se transfirieron en 90 mL de caldo de almidón al 1,0 % p/v y se incubaron por 24 horas a 37 °C y 120 rpm. A partir de este cultivo se inocularon 15 mL de 6x108 células/mL en el medio de cultivo preparado con residuos de papa y se incubaron durante 36 horas a 37 °C y 120 rpm en una incubadora con agitación (New Brunswick™ Innova® 40). Como control negativo se incubó bajo las mismas condiciones una réplica de medio de cáscaras de papa estéril (sin inocular) con cada pH evaluado. Para la producción de amilasas, se hizo una réplica de cada control positivo en caldo de almidón al 1,0 % p/v y pH de 5,0, 7,0 y 8,0 debidamente inoculados y como control negativo se incubó un caldo de almidón al 1 % p/v y pH de 7,0 sin inocular.
Obtención de extractos enzimáticos crudos
A las 0 y 12 horas de cultivo se tomaron 4 g de muestra para facilitar el muestreo, ya que la viscosidad del medio no permitió la toma de muestras líquidas, en tanto que a las 24 y 36 horas se tomaron 4 mL. Las muestras se centrifugaron a 4.500 rpm durante 20 minutos a 7 °C en una centrífuga Hettich - Rotanta 460R. Los sobrenadantes o extractos enzimáticos crudos se preservaron a -20 °C de uno a cinco días para determinar la actividad amilolítica.
Cuantificación de la concentración de almidón durante la fermentación
A las 0, 12, 24 y 36 horas de cultivo se tomó aproximadamente 1 g o 1 mL de cada muestra y se adicionaron 5 mL de solución ácida de cloruro de calcio. Esta mezcla se llevó a la autoclave (Sanyo) por 10 minutos a 120 °C y 15 psi; posteriormente se agregó 1 mL de solución de acetato de zinc a partir de ácido acético (21,9 g de acetato de zinc Merck, 3 mL de ácido acético Merck en 100 mL de agua destilada) más 1 mL de solución de ferrocianuro de potasio al 10,5 % p/v que se llevó a un volumen final de 25 mL con solución ácida de cloruro de calcio y se centrifugó a 4.500 rpm durante 20 minutos en una centrifuga (Hettich - Rotofix 32A) (Englyst, et al., 2006). La cuantificación del almidón se determinó por espectrofotometría (Ortiz, et al., 2015). Para la curva de calibración se prepararon soluciones de almidón soluble de grado analítico (Merck) a diferentes concentraciones (0,02, 0,04, 0,05, 0,06, 0,08 y 0,1 g/L), se revelaron con solución de Lugol y su absorbancia se leyó a 650 nm en un espectrofotómetro Shimadzu UV - 1800. Un mL de los sobrenadantes obtenidos de la extracción del almidón se reveló con solución de Lugol y su absorbancia se leyó a 650 nm.
Cuantificación de la actividad enzimática amilolítica
A 1 mL de los extractos enzimáticos crudos se le adicionó 1 mL de almidón al 1 % con tampón fosfato y pH de 6,5. Simultáneamente, se preparó un blanco enzimático usando 1 mL de caldo de almidón y tampón con pH de 6,5 más 1 mL de agua destilada. Los extractos y los blancos enzimáticos se llevaron a un baño serológico (Barnstead Lab-Line) a 60 °C durante una hora para llevar a cabo la reacción enzimática. Las reacciones se detuvieron con baño de hielo durante 15 minutos y se centrifugaron a 4.500 rpm durante 20 minutos a 7 °C. Se tomaron alícuotas de 1 mL de los sobrenadan tes para determinar la concentración de glucosa con el método del ácido 3,5 dinitrosalícilico (DNS) (Olanbiwoninu & Fasiku, 2015). La absorbancia se leyó a 540 nm en un espectrofotómetro Shimadzu UV - 1800. La actividad enzimática amilolítica produ cida se determinó en unidades enzimáticas (U/mL), es decir, la cantidad de enzima que produce un μmol de glucosa por minuto y por mililitro (Abd-Elhalem, et al., 2015; Bryjak, 2003).
Resultados y discusión
Caracterización de los residuos de papa
Los resultados de la caracterización de las de cáscaras de papa (Tabla 1) evidenciaron un contenido de almidón de 1,30 % p/p. A partir de este porcentaje se definió la cantidad de residuos necesaria en los medios de cultivo para tener una concentración final de almidón de 0,15 % p/v. Se seleccionó esta concentración porque se evidenció que la viscosidad aumentaba a medida que aumentaban las concentraciones de almidón en los medios de cul tivo preparados con cáscaras de papa, lo que dificultaría la disponibilidad de nutrientes y el control de variables durante la fermentación sumergida. Por tal razón, las concentraciones finales de almidón en los medios preparados con cáscaras de papa difirieron de las de los medios preparados con almidón soluble.
Según algunos estudios consultados, el contenido de almidón de cáscara de papa fluc túa entre 7,80 % p/p (Sepelev & Galoburda, 2015) y 16,83 % p/p (Liang & McDonald, 2014). En un estudio con residuos de papa de variedades colombianas se evidenció que, dependiendo de la variedad, las concentraciones de almidón en base seca estuvieron entre 3,38 y 8,79 % p/p, por lo que se concluyó que el contenido y la calidad de almidón depen den tanto de la variedad del tubérculo como de las condiciones del cultivo (Lizarazo, et al., 2015). Dado que el objetivo de este estudio era aprovechar residuos agroindustriales para la obtención de enzimas independientemente de su contenido de almidón, la formu lación del medio para la producción de amilasas se hizo a partir de las cáscaras de papa recolectadas en restaurantes y después caracterizadas.
Formulación de los medios de cultivo
Los análisis fisicoquímicos de los residuos permitieron definir las cantidades de nitrógeno, fosfatos, calcio y magnesio requeridos para suplementar los medios de cultivo a partir de 23,5 g de cáscaras de papa. Los porcentajes de nutrientes requeridos se muestran en la tabla 2 comparados con un medio base preparado con almidón soluble.
Los requerimientos mínimos de nutrientes se calcularon a partir de un medio de referencia denominado caldo de almidón preparado a partir de almidón soluble a una concentración del 1,0 % p/v (Pedroza & Matiz, 2007). Las cantidades de magnesio, nitrógeno y fosfatos en el medio fueron aportadas directamente por las cáscaras de papa, sin embargo, la cantidad de calcio en los residuos fue alrededor de 1.000 veces menor de la necesaria, razón por la cual se adicionó una solución de cloruro de calcio dihidratado a una concentración de 225 mg/L, lo que representó una concentración final de calcio de 0,006 % p/v en los medios de cultivo.
Consumo de almidón
El contenido de almidón se cuantificó en cada uno de los medios de cultivo para establecer su consumo durante el tiempo de fermentación. Las concentraciones de almidón en los medios preparados a partir de residuos de cáscaras de papa a pH de 5,0, 7,0 y 8,0 se redujeron hasta un 53 % al cabo de 36 horas de fermentación (Figura 1), en tanto que hubo una reducción de hasta el 98 % en los medios preparados con almidón soluble tan solo en las primeras 12 horas del análisis (Figura 2). En todos los controles negativos, en los cuales no se inoculó la cepa, las concentraciones promedio de almidón fueron constantes en el tiempo (Figura 3), lo cual indica que, aunque B. amyloliquefaciens A16 fue capaz de utilizar el almidón disponible en las cáscaras de papa, el proceso fue más eficiente hidrolizándolo en el caldo de almidón al 1,0 % p/v.

Figura 1 Consumo de almidón en los medios de cultivo con cáscaras de papa a pH de 5,0, 7,0 y 8,0. La concentración de almidón se evaluó a las 0, 12, 24 y 36 h de fermentación.
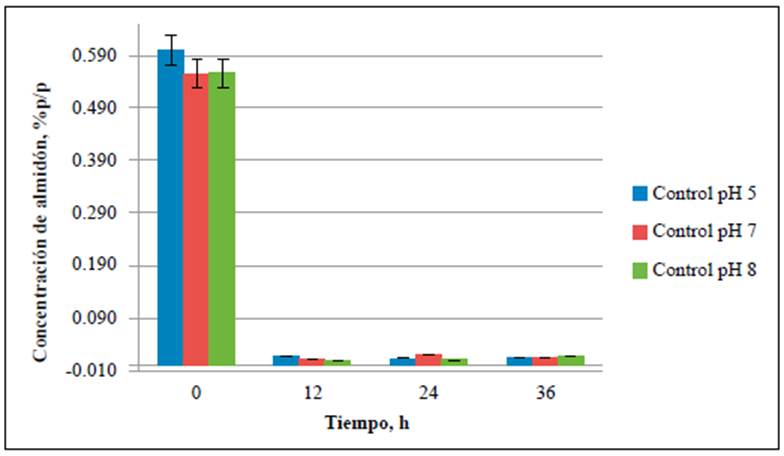
Figura 2 Consumo de almidón en los medios de cultivo de caldo de almidón al 1 % p/v a pH de 5,0, 7,0 y 8,0. La concentración de almidón se evaluó a las 0, 12,24 y 36 h de fermentación.
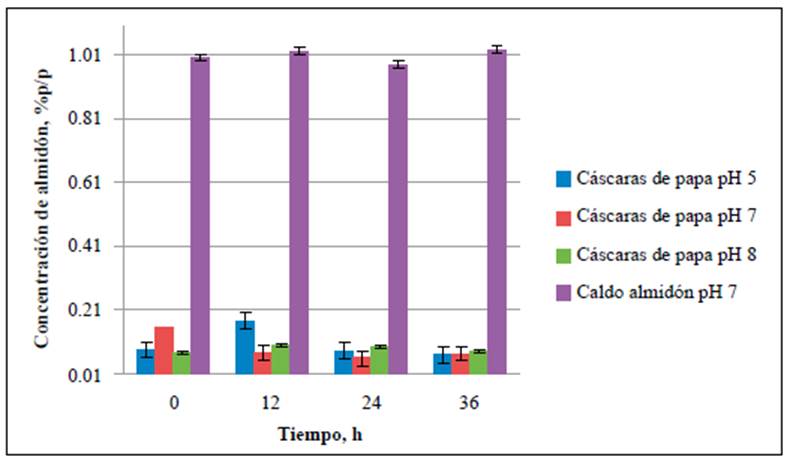
Figura 3 Concentración de almidón para los medios y el control negativo. Estos medios no se inocularon. La concentración de almidón se evaluó a las 0,12, 24 y 36 h de fermentación.
Utilizando un consorcio microbiano para la degradación del almidón en cáscaras de papa, Liang & McDonald (2014) obtuvieron una concentración final de almidón de 2,07 % en base seca, lo que equivalió tan solo al 12,3 % en la reducción de la concentra ción del sustrato e indica que el consumo de almidón fue más eficiente con la cepa B. amyloliquefaciens (A16) usada en este estudio.
Se evidenció un mayor consumo del sustrato en los medios preparados a partir de almidón soluble comparados con los medios de cáscaras de papa (Figuras 1-3), lo que podría deberse a la disponibilidad del almidón en los medios, ya que en el caldo de almidón hidrosoluble al 1 % p/v el sustrato esta homogéneamente distribuido en el medio, en tanto que en los medios preparados con cáscaras de papa la mayor concentración de almidón se encuentra dentro de estas, una matriz compleja que, además de tener almidón, contiene otros polímeros como pectina, celulosa y hemicelulosa (Lizarazo, et al., 2015). Además, con el paso del tiempo la producción de azúcares simples en el medio afecta la produc ción de la enzima ralentizando la degradación del almidón (El-Fallal, et al., 2012). La concentración de almidón residual podría ser un indicativo de cuándo finalizar el proceso de fermentación, ya que se ha encontrado que a concentraciones < 0,1 % de almidón en el medio este permanece constante (Smerilli, et al., 2015), lo que sugiere que la producción de amilasas disminuye debido a la reducción de la concentración del sustrato. Esto también se evidenció en el presente estudio, pues las concentraciones de almidón de los medios evaluados permanecieron entre 0,08 ± 0,005 y 0,09 ± 0,021 % p/v durante las últimas 12 horas de análisis (Figura 1).
Producción de amilasas
Las amilasas producidas por B. amyloliquefaciens (A16) a partir de cáscaras de papa con 0,16 % de almidón a las 36 horas de fermentación presentaron mayor actividad amilolítica cuando el pH del medio de cultivo se ajustó a 5,0. Según los resultados del ANOVA de un factor con un nivel de significación de 0,01, no se registraron diferencias significativas entre la actividad amilolítica de los extractos enzimáticos obtenidos en los medios con cáscaras de papa a diferentes pH y el caldo de almidón (p=0,054) en cada período de tiempo evaluado. Según los resultados de esta prueba, las amilasas producidas en el sus trato con cáscaras de papa presentaron actividades enzimáticas comparables a las de las enzimas obtenidas en el caldo de almidón empleado como control positivo. Ello indica que el almidón disponible en los residuos de cáscaras de papa es una alternativa de bajo costo para la obtención de amilasas, pues evita el uso de almidón comercial, reduciendo así los costos de producción y el impacto ambiental.
La actividad amilolítica se evaluó a las 0, 12, 24 y 36 horas de fermentación y se evidenció que con B. amyloliquefaciens a un pH de 5,0 se obtuvo el mayor consumo de almidón (Figura 1) y la mayor actividad amilolítica (Figura 4), lo que coincide con un estudio de Quintero, et al. (2010) en el que los pH óptimos para la producción de amilasas a partir de microorganismos de este mismo género fluctuaron entre 5,0 y 7,0.

Figura 4 Actividad enzimática de las amilasas producidas en medios con cáscaras de papa a pH de 5,0, 7,0 y 8,0
La actividad enzimática de las amilasas obtenidas a pH de 5,0, 7,0 y 8,0 (Figura 4) fue superior a las reportadas (1,00 U/mL a 2,50 U/mL) para las enzimas producidas por Pseudomonas stutzeri después de 30 horas de cultivo en medios con el mismo rango de pH y con una concentración de almidón entre 0,2 % p/v a 1,0 % p/v (Dutta, et al., 2016). Asimismo, los resultados de las actividades amilolíticas del presente estudio fueron superiores a las obtenidas por Jadhav, et al. (2013) a partir de Bacillus sp. en un medio preparado con extracto de cáscaras de papa al 50 % de p/v luego de 48 horas de fermentación, que resultó en 0,8 U/mL y 0,7 U/mL de amilasas usando un medio con cáscaras de papa y suplemento de peptona. Olanbiwoninu & Fasiku (2015) obtuvieron 5,4 U/mL de amilasas a partir de B. pumilusy de 3,9 U/mL utilizando B. subtilis en medios con batata fermentados a 55 °C. Por otro lado, en fermentaciones en estado sólido (SSF) de este mismo residuo, se han evidenciado menores actividades amilolíticas, con un máximo de 3,05 U/mL a un pH de 7,0 (Obi, et al., 2019). Sin embargo, Abd-Elhalem, et al. (2015) fermentaron con B. amyloliquefaciens durante 30 horas y obtuvieron nivel de amilasas de 155,2 U/mL a partir de residuos de papa con 2,0 % de almidón, concentración mayor a la evaluada en este estudio.
Las amilasas producidas en caldo de almidón al 1,0 % de p/v y pH de 5,0, 7,0 y 8,0 (controles positivos) tuvieron el mismo comportamiento que los medios con cáscaras de papa en los que la mayor actividad amilolítica se obtuvo a un pH 5,0 (Figura 5). Las amilasas obtenidas en el medio de control a un pH de 5,0 presentaron una actividad comparable a las de las enzimas extraídas en una fermentación a un pH de 7,0 utilizando una cepa de B. amyloliquefaciens y empleando como control un medio preparado con almidón soluble al 1,0 % p/v, con lo que se registraron 78,2 U/mL luego de 36 horas de incubación (Abd-Elhalem, et al., 2015).
Las actividades amilolíticas obtenidas después de las 24 horas de fermentación a partir de B. amiloliquefaciens A16 en caldo de almidón al 1,0 % p/v fueron superiores (Figura 5) a las de las amilasas producidas a partir de Aspergillus niger (≈ 50 U/mL) en un medio preparado con salvado de trigo hidrolizado a 0,6 % p/v de almidón a 28 °C durante cuatro días, resultados reportados en un estudio piloto en el cual se evaluaba el potencial comercial de estas amilasas (Khalid-Bin-Ferdaus, et al., 2018). Estos datos sugieren que las amilasas del aislamiento A16 tienen potencial para emplearse en procesos industriales, con la ventaja de que se producen a partir de sustratos sin tratamiento previo y con bajas concentraciones de almidón. Además, B. amiloliquefaciens A16 es de fácil cultivo y rápido crecimiento, lo que reduce los tiempos de fermentación.
Los medios con cáscaras de papa se formularon en una concentración de almidón de 0,16 % p/v porque, debido a la gelificación del almidón, por encima de esta concentración el medio se hacía más viscoso y en este estudio se había propuesto hacer las fermentaciones en estado líquido. Los medios de control (caldo de almidón a 1 % p/v) presentaron mayor actividad amilolítica (Figura 5) en comparación con los medios preparados con cáscaras de papa (Figura 4), lo que se debe a la mayor disponibilidad de sustrato en los medios de control, pues la adición de almidón soluble en medios líquidos normalmente mejora la producción de amilasas (El-Fallal, et al., 2012).
El objetivo del presente estudio fue evaluar la viabilidad de la producción de amilasas en medios líquidos con cáscaras de papa utilizando una cepa de B. amyloliquefaciens con diferentes pH. Los resultados del estudio demostraron que con estos residuos agro-industriales se produjeron amilasas con actividades que fluctuaron entre 32,6 ± 0,61 y 44,2 ± 0,21 U/mL después de 36 horas de fermentación y que la mayor producción de enzimas se obtuvo cuando el sustrato se ajustó a un pH de 5,0. Estas actividades son comparables a las obtenidas en otros estudios y a las producidas en caldo de almidón al 1,0 % p/v, lo que demuestra que el aislamiento de B. amyloliquefaciens A16 es una cepa promisoria para la producción de amilasas a partir de residuos de papa.
Conclusiones
Los residuos de cáscaras de papa pueden ser aprovechados como sustratos para la pro ducción de amilasas en fermentación sumergida a partir de la cepa B. amyloliquefaciens A16 aislada de suelos de humedales de Bogotá. Estos residuos son una fuente de almidón de fácil acceso que, tratados para la formulación de medios de cultivo con concentraciones de almidón del 0,15 % p/v, permiten la obtención de amilasas con actividades enzimáticas similares a los producidas en medios de cultivo preparados con almidón hidrosoluble al 1,0 % p/v y a las obtenidas en otros estudios. Se comprobó que tanto el sustrato como la cepa bacteriana evaluados en este estudio podrían ser una alternativa para la producción de amilasas a nivel industrial.


















