Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.9 no.2 Popayán Jul.y/Dec. 2011
BACTERIAS NATIVAS SOLUBILIZADORES DE FOSFATOS PARA INCREMENTAR LOS CULTIVOS EN EL DEPARTAMENTO DE CÓRDOBA-COLOMBIA
NATIVE PHOSPHATE SOLUBILIZING BACTERIA TO INCREASE THE CROPS IN THE DEPARTMENT OF CORDOVA-COLOMBIA
BACTÉRIA NATIVO SOLUBILIZER DE FOSFATOS AO AUMENTO DAS COLHEITAS NO DEPARTAMENTO DE CORDOVA-COLÔMBIA
CECILIA LARA1, LINA M ESQUIVEL AVILA2, JORGE L NEGRETE PEÑATA3
1 Ph.D. Química. Laboratorio de Biotecnología. GRUBIODEQ. Universidad de Córdoba.
2 Bacterióloga. Laboratorio de Biotecnología. GRUBIODEQ Universidad de Córdoba.
3 Bacteriólogo. Laboratorio de Biotecnología. GRUBIODEQ Universidad de Córdoba.
Correspondencia: lara_mantilla_cecilia@hotmail.co
Recibido para evaluación: 28/02/2011. Aprobado para publicación: 01/07/2011
RESUMEN
El objetivo del presente trabajo fue caracterizar y evaluar microorganismos nativos fosfato solubilizadores a partir de muestras de suelo en zona rural del departamento de Córdoba. Se realizó un aislamiento primario en medio SMRS1 en el cual se observó la aparición de halos de solubilización; al mismo tiempo se realizó una caracterización macroscópica y microscópica de las colonias. Se observó, como población predominante bacilos Gram negativos con un porcentaje del 93%. Se realizó el análisis cualitativo de la cepas instaladas en el medio NBRIP, en esta fase fueron seleccionadas las cepas que presentaran IS mayores de 3 mm. Las cepas seleccionadas por su capacidad fosfato solubilizadora fueron analizadas mediante el sistema API 20 E y API 20 NE. Las bacterias aisladas correspondieron a: Burkoldelia cepacia, Enterobacter cloacae, Pantoea sp, Aeromonas hydrophila, Enterobacter nakasaki. Burkoldelia cepacia fue el microorganismo con mayor capacidad fosfato solubilizadora y fue utilizado para realizar un pequeño ensayo en semillas de rábano (Rhapanus sativus). Se encontró que a una concentración de 108 UFC/mL los resultados fueron favorables en el crecimiento y en el peso fresco de la planta.
PALABRAS CLAVE:
Burkoldelia cepacia, bacterias solubilizadores de fosfatos, rábano (Rhapanus sativus).
ABSTRACT
The aim of this study was to characterize and evaluate native phosphate solubilizing microorganisms from soil samples in the rural area of Cordoba. Primary isolation was performed in the middle SMRS1 in which we observed the appearance of halos of solubilization, at the same time there was a macroscopic and microscopic characterization of the colonies. Was observed, as gram-negative bacilli predominant population at a rate of 93%. We performed qualitative analysis of the strains isolated NBRIP supplemented, at this stage were selected for strains that showed greater than 3 mm IS strains selected for their ability to solubilize phosphate were reviewed using the API 20 E and API 20 NE. The isolated bacteria were: Burkoldelia cepacia, Enterobacter cloacae, Pantoea sp, Aeromonas hydrophila, Enterobacter Nakasaki. Burkoldelia cepacia was the microorganism most phosphate solubilizing capacity and was used to conduct a small trial in radish (Rhapanus sativus) seeds. It was found that a concentration of 108 CFUI mL the results were favorable for growth and fresh weight of the plant.
KEYWORDS:
Burkoldelia cepacia, Phosphate solubilizing bacteria, radish (Rhapanus sativus).
RESUMO
0 objetivo deste estudo foi caracterizar e avaliar nativa microrganismos solubilizadores de fosfato a partir de amostras do solo na área rural de Córdoba. Isolamento primário foi realizado no SMRS1 meio em que se observou o aparecimento de halos de solubilização, ao mesmo tempo, houve uma caracterização macroscópica e microscópica das colônias. Observou-se, como gram-negativos população bacilar predominante, a uma taxa de 93%. Foi realizada uma análise qualitativa das cepas isoladas NBRIP completados, nesta etapa foram selecionados para as estirpes que apresentaram maior do que 3 mm é cepas selecionadas por sua capacidade de solubilização foram analisados utilizando a API 20 E e API 20 NE. As bactérias isoladas foram: Burkoldelia cepacia, Enterobacter cloacae, Pantoea sp, Aeromonas, Enterobacter Nakasaki. Cepacia Burkoldelia foi o microrganismo mais capacidade de solubilização de fosfato e foi usado para realizar um pequeno teste em sementes de rabanete (Rhapanus sativus). Verificou-se que uma concentração de 108 UFC/mL, os resultados foram favoráveis para o crescimento eo peso fresco da planta.
PALAVRAS-CHAVE:
Burkoldelia cepacia, microrganismo solubilização de fosfato, rabanete (Rhapanus sativus).
INTRODUCCIÓN
El fósforo (P) es un nutriente esencial para el desarrollo de las plantas; desempeña un papel fundamental en la síntesis de proteínas, biosíntesis de lípidos, síntesis de clorofila, compuestos carotenoides, metabolismos de los ácidos orgánicos, biogénesis de los glúcidos, entre otros [1]. El fósforo es el segundo elemento limitante en las cosechas, después del nitrógeno, debido a su gran insolubilidad; para que pueda ser asimilado, es necesario que se encuentre como una de las formas de ortofosfato: P04H2- o P04H-2 en la disolución del suelo. La mayor parte del fósforo inorgánico es absorbido en las plantas en forma de P04H2- y en menor proporción como PO [1,2].
Algunas especies microbianas del suelo tienen la capacidad de convertir las formas insolubles del fósforo en formas asimilables para las plantas; la acción de solubilización puede generarse a través de procesos como producción de ácidos orgánicos, quelación e intercambio de reacciones [3]. El ácido oxálico producido por microorganismos pueden quelar el Ca2+ , Mg2+ y Fe3+, desestabilizando así el mineral de procedencia del fosfato para finalmente solubilizarlo [4]. El mecanismo más usado por las poblaciones microbianas para solubilizar el fosfato es a través de la producción de ácidos orgánicos, los cuales actúan sobre formas insolubles, fosfato tricálclco, fosfato dicálcico, hidroxiapatita y roca fosfórica.
Los ácidos orgánicos permiten que haya solubilización debido a que la presencia de estos implica un descenso en el pH hasta valores aproximados a 2; valores necesarios para que se pueda llevar a cabo la solubilización. La producción de ácidos orgánicos a partir de la fermentación de la glucosa da como resultado la acidificación de las células y sus alrededores [5].
Las bacterias que solubilizan activamente el fósforo representan un 10% de la población microbiana del suelo. Un mecanismo indirecto ocurre cuando los microorganismos asimilan directamente los fosfatos insolubles acumulándose en sus células y liberándolos posteriormente. Dentro de los géneros encontrados se conocen los hongos como Aspergillus, Fusarium y Sclerotium. Un segundo grupo lo constituyen los Actinomycetes, y las bacterias entre las que se pueden mencionar a Bacillus, Flavobacterium, Burkholderia, rizhobium y Pseudomonas [6].
El departamento de Córdoba al igual que otros departamentos de Colombia basa gran parte de su economía en el sector agrícola, siendo sus cultivos más importantes coco, sorgo, maíz, arroz, plátano, yuca y algodón; estos suelos tropicales no escapan de la problemática ocasionada por la deficiencias en el fósforo y por esta razón los agricultores se ven en la necesidad de recurrir a los fertilizantes químicos aumentando los costos en la producción.
Conociendo la importancia del fósforo para el óptimo desarrollo de las plantas y la problemática que envuelve su deficiencia en los cultivos, el objetivo del presente trabajo de investigación fue caracterizar y evaluar microorganismos nativos fosfato solubilizadores a partir de muestras de suelo en el departamento de Córdoba.
MÉTODO
Sitio de muestreo
Se realizó un muestreo aleatorio de los suelos, en la finca "Las Guayabas" ubicada en sector rural del municipio de Montería; altura promedio de 20 msnm, precipitación 1200 - 1300 mm, humedad relativa 80 - 90 % y temperatura, 25-32°C. Se escogieron al azar muestras de suelo (rizósfera) de cultivo de guayaba agria (Psidium araca), zonas sin cultivar (rastrojos), maleza y materia orgánica en descomposición. Se midió de pH a las muestras de suelos obtenidas.
Aislamiento de las bacterias solubilizadoras
Se tomaron 4g de muestra previamente homogenizadas y se adicionaron a 36 mL de solución salina (0.85%); a partir de ésta se realizaron diluciones seriadas de 10-1 a 10-5. Las bacterias fueron aisladas usando medio SMRS1 que contenía púrpura de bromocresol como indicador de pH, sulfato de amonio y extracto de levadura como fuente de nitrógeno, cloruro de sodio y potasio para regular la presión osmótica y otros componentes como sulfato de magnesio, sulfato de hierro como cofactores enzimáticos [7].
Las condiciones de crecimiento fueron: temperatura de 27°C y tiempo de incubación de 48 a 72 horas hasta observar crecimiento y presencia de solubilización alrededor de las colonias. Se seleccionaron las colonias que presentaron halos de solubilización y se realizaron pases celulares en medio SMRS1, por la técnica de agotamiento en placa, a temperatura de 27°C durante 72 horas, con el objetivo de obtener cepas puras.
Evaluación cualitativa de la solubilización de fosfato
La capacidad cualitativa de solubilización se determinó en medio NBRIP [8]. Las cajas de NBRIP inoculadas con cada una de las cepas puras se incubaron a 28°C durante 7 días hasta la aparición de halos claros. El tamaño de los halos se calculó según el índice de solubilización: IS=A/B (A: diámetro de la colonia + diámetro del halo y B: diámetro de la colonia) [9] y se seleccionaron las cepas que mostraron índices de solubilización mayores a los 3 mm; las mediciones se realizaron a los 3 y 7 días respectivamente después de la inoculación, con el fin de evaluar el comportamiento de las cepas a través de los días.
Todos los ensayos se realizaron por triplicado.
Caracterización macroscópica y microscópica de las colonias.
Se realizó la identificación de las colonias teniendo en cuenta características macroscópicas de forma, color, tamaño y consistencia utilizando medios selectivos. Se identificó la morfología microscópica mediante tinción de Gram y características fenotípicas y bioquímicas de acuerdo al manual Bergey's [10]; se realizó prueba catalasa y oxidasa. Se utilizaron además los kit de identificación API20NE y API20E (bloMérieux) y el programa Informático de Identificación APIWEB™.
Ensayos preliminares en plantas de rábano
Para la prueba se escogió la bacteria que mejor resultado demostró cualitativamente en la solubilización de fosfato es decir la de mayor IS; se prepararon diferentes concentraciones del microorganismo: 106, 107 y 108 UFC en caldo nutritivo a temperatura ambiente (28±2°C), manteniendo una agitación constante de 150 rpm en un shaker por un período de 24 horas; a estos preparados se les llamó Bioinoculantes.
Se utilizó la semilla comercial 'Rábano Crimson Giant Variedad' (Instituto Colombiano Agropecuario, ICA). Las plantas de rábano se desarrollaron en predios de la Universidad de Córdoba, a temperatura promedio de 29°C y humedad relativa de 79%; el suelo utilizado fue de textura arcillosa [11]. No se utilizó ningún tipo de plaguicida.
Durante un tiempo de 60 minutos las semillas fueron embebidas en los bioinoculantes hasta cubrirlas y posteriormente fueron sembradas; se realizaron cuatro tratamientos como son:
Tratamiento 1 (control): Semillas sin ningún tipo de tratamiento.
Tratamiento 2: Semillas tratadas con el bioinoculante 106 UFC/mL.
Tratamiento 3: Semillas tratadas con el bioinoculante 107 UFC/mL.
Tratamiento 4: Semillas tratadas con el bioinoculante 108 UFC/mL.
Posterior al tratamiento aplicado a las semillas, se realizó la siembra de éstas en canastas las cuales presentan 30 divisiones cada una, usando media canasta (15 divisiones) para cada tratamiento. Las semillas fueron sembradas a 1 centímetro de profundidad, colocando una semilla en el centro de cada espacio de la canasta, para un total de 30 semillas por caja.
Al finalizar el ensayo preliminar a los 8 días se evaluaron los siguientes parámetros biométricos [12, 13]: a) longitud de la planta (cm): se midió desde la base del tallo hasta la hoja más larga de cada una de las plantas muestreadas; b) Longitud de la raíz (cm): se realizó la medición de la raíz principal de cada planta muestreada; c) peso fresco de la planta (mg): se pesó en una balanza analítica cada una de las plantas muestreadas, recién extraídas del suelo.
RESULTADOS
Los resultados obtenidos de pH indicaron valores entre 6.6 - 7.4. Las condiciones en que se encuentra el pH del suelo son determinantes para la solubilización del fosfato; cuando los suelos presentan pH muy ácidos, la solubilidad del aluminio y el hierro es elevada, y estos elementos se precipitan con el fósforo en forma de compuestos insolubles, no aprovechables para las plantas; a su vez, con un pH alcalino también es limitada la disponibilidad del fósforo por la formación de fosfatos de calcio (apatitas) insolubles. A valores de pH cercanos a la neutralidad se presume una dinámica alta de los fosfatos de caldo apatítico y no-apatítico, que se solubilizan con mayor facilidad [14]; también los microorganismos realizan la mayor mineralización del fosforo orgánico [14].
Bacterias aisladas
Se obtuvieron un total de 61 bacterias con capacidad solubilizadora de fosfato. (Figura 1)
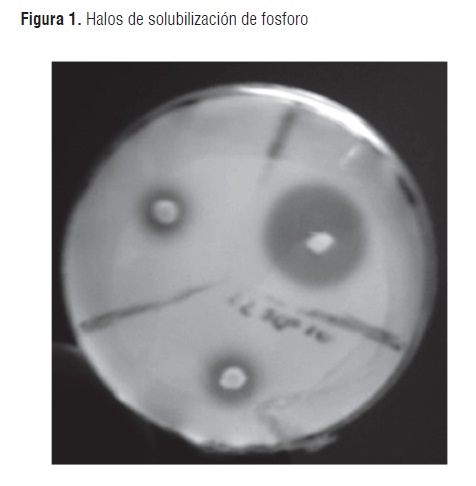
Las bacterias que solubilizan activamente el fósforo representan un 10% de la población microbiana del suelo. Se trata fundamentalmente de microorganismos como Bacillus, Micrococcus, Mycobacterium, Pseudomonas y algunos hongos [6]. Mediante el uso de la coloración de Gram, se logró evidenciar que la mayoría de las bacterias aisladas correspondían a bacilos Gram negativos (93%); este dato concuerda con estudios realizados por otros autores [15]; de manera similar [16] en suelos amazónicos se reportan bacterias como Pseudomonas spp, P. cepacea, P. gladioli, Xanthomonas spp, X. maltophilia, Enterobacter agglomerans, todas estas bacilos Gram negativos.
En la investigación también se encontraron bacilos Gram positivos (5%) y cocos Gram positivos (2%).
Evaluación cualitativa de la solubilización de fosfato
Los resultados tras la medición de los índices de solubilización (IS), arrojaron valores desde 1.5 hasta 4.2 mm. Los halos de solubilización fueron medidos al tercer y séptimo día respectivamente. Se observó que para algunas cepas este intervalo de tiempo era de gran provecho pues el halo total aumentaba de tamaño y el tamaño de la colonia se conservaba, obteniéndose de esta manera buenos índices de solubilización. Caso contrario ocurría con algunas cepas que se detenían en la formación del halo total y en algunos casos aumentaba el tamaño de la colonia obteniéndose entonces índices de solubilización muy bajos. Se escogieron las cepas con los mayores IS (20 bacterias) comprendidos entre 3.0 y 4.2 mm (tabla 1).
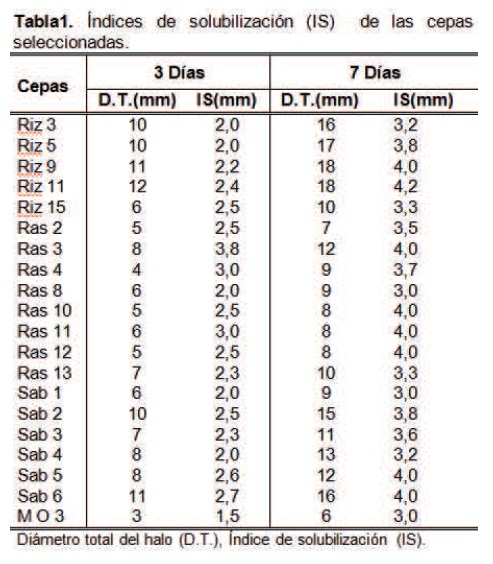
Se identificaron las bacterias de mayor IS como Burkholderia cepacia, Pantoea sp, Pseudomona putida, Pseudomona luteola, Aeromona hydrophilia, Enterobacter Sakasaki y Enterobacter cloacae. Algunas de estas bacterias fueron identificadas y concuerdan con las obtenidas por otros autores [17,18,20], como es el caso de Burkholderia cepacia y Aeromonas hidrophyla.
Ensayo preliminar en plantas de rábano
La bacteria utilizada para el ensayo fue Burkholdelia cepacia. El rábano (Raphanus sativus) fue empleado como planta modelo porque presenta un crecimiento rápido, es genéticamente homogéneo, produce cosechas en un tiempo corto y realiza una gran absorción de fósforo del suelo [19].
Transcurridos 8 días después de las siembra de las semillas de rábano (Raphanus sativus), se observó crecimiento en todos los tratamientos y se realizó entonces la medición de los parámetros biométricos establecidos para este ensayo. La Longitud de la planta (cm) y la Longitud de la raíz, denotaron valores más altos para los tratamientos T2 y T4, sin embargo no se observaron diferencias estadísticamente significativas. Para el caso del Peso fresco (mg), se evidenciaron mejores resultados en las plantas de T4 y T2, estadísticamente significativos, seguidos por valores relativamente semejantes en T2 y T1. (Ver Figura 2)

Los resultados preliminares de este ensayo evidencian el comportamiento inicial de las plantas de rábano frente a los diferentes tratamientos utilizando la bacteria solubilizadora de fosfato más representativa; pese a que no se contó con un tiempo adecuado para realizar un estudio más completo debido a las condiciones climatológicas durante el ensayo, que se presentaron con lluvias fuertes y repetitivas, los resultados demuestran el efecto benéfico de la bacteria solubilizadora de fosfato.
Los resultados de esta investigación contribuyen al conocimiento de microorganismos autóctonos con potencial en la solubilización de fosfatos, que a futuro pueden ser evaluados y utilizados como biofertillzante, para mejorar la productividad de los cultivos, acorde con las necesidades del sector agrícola de Córdoba; sustituyendo ó minimizando la utilización de productos químicos, minimizando los costos y contribuyendo a mejorar la fertilidad del suelo.
CONCLUSIONES
Se comprobó el efecto biofertilizante de la bacteria nativa Burkholdelia cepacia, solubilizadora de fosfato, sobre el crecimiento de plantas de rábano.
El conocimiento de bacterias nativas eficientes en la solubilización de fosfatos representa un potencial para mejorar la productividad en los cultivos en la región de Córdoba, permitiendo un mayor beneficio para los agricultores.
AGRADECIMIENTOS
A la Universidad de Córdoba por financiar el presente proyecto de investigación.
REFERENCIAS
[1] NAVARRO, S. and NAVARRO, G. Química Agrícola, Editorial Ediciones Mundi-prensa. Madrid España, p 232-250. 2003. [ Links ]
[2] HAMEEDA, B., HARINI, G., RUPELA, 0., WANI, P. and REDDY, G. Growth promotion of maize by phosphate - solubilizing bacteria isolated from compost and macrofauna. Microbial Research., 53, 65-71. 2006. [ Links ]
[3] BEGONIA, M., BEGONIA, G., MILLER, G., GILLIARD, D. and YOUNG, C. Phosphatase Activity and Populations of Microorganisms from Cadmium and Lead Contaminated Soil. Bull. Environ. Contam. Toxicol., 73,1025-1032. 2004. [ Links ]
[4] RASHID, M., KHALIL, S., AYUB, N., ALAM, S. and LATIF, F. Organic Adds Production and Phosphate Solubilization by phosphate solubilizing microorganisms (PSM) under in vitro Conditions. Pakistan Journal of Biological Sciences., 7(2), 187-196. 2004. [ Links ]
[5] HALDER, A.K. and CHAKRABARTTY, P.K. Solubilization of inorganic phosphates by Rhizobium. Folia Microbiol., 38,325-330.1993. [ Links ]
[6] COYNE, M. Microbiología del Suelo: Un enfoque exploratorio. Ed. Paraninfo. Capítulo 16. 2000. [ Links ]
[7] OTÁLORA J., PATIÑO, L., MARTÍNEZ, M. y PEDROZA, A. Estandarización de una técnica cualitativa de producción de fosfatasas producidas a través de microorganismos solubilizadores de fosfato. Tesis Microbiología Industrial. Pontificia Universidad Javeriana. Bogotá, p 21-30. 2003. [ Links ]
[8] NAUTIYAI, C.S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiol. Lett, 170, 265-270. 1999. [ Links ]
[9] KUMAR, V. and NARULA, N. Solubilization of organic phosphates and growth emergence of wheat as affected by Azotobacter chroococum mutans. Boil. Fertile. Soils., 28, 301-305.1999. [ Links ]
[10] BUCHANAN, R.E. and GIBBONNS, N.E. Bergey's Manual of Determinative Bacteriology, 9th de Baltimore: Williams and Wilkins Company, p 135-136. 1994. [ Links ]
[11] DEGIOVANNI, V., GÓMEZ, J. y SIERRA, J. Análisis de crecimiento y etapas de desarrollo de tres variedades de arroz (Oryza sativa L.) en Montería, Córdoba. Temas Agrarios. 9(1). Enero - Junio, p 21-29. 2004. [ Links ]
[12] HERNÁNDEZ, A. Obtención de un biopreparado a partir de rizobacteria asociadas al cultivo del maíz (Zea Mays L). Tesis de Doctorado en Ciencias Biológicas. Universidad de La Habana HAMEEDA, p 45-67. 2002. [ Links ]
[13] RAMÍREZ P.R. y PÉREZ A.M. Evaluación del potencial de los biosólidos procedentes del tratamiento de aguas residuales para uso agrícola y su efecto sobre el cultivo de rábano rojo (Raphanus sativus L). Rev. Fac. Nal. Agr. Medellín. 59 (2), p 3543-3556. 2006. [ Links ]
[14] CLAVIJO, J. et al. Fertilidad de los Suelos, Diagnóstico y Control. Sociedad Colombiana de la Ciencia del Suelo. Editorial Guadalupe LTDA. 2ed Bogotá, p 32. 2001. [ Links ]
[15] BOBADILLA, C. y RINCÓN, S. Aislamiento y producción de bacterias fosfato solubilizadoras partir de compost obtenido de residuos de la plaza. Tesis Microbiología Industrial. Pontificia Universidad Javeriana, p 10-23. 2008. [ Links ]
[16] USECHE, Y., VALENCIA, H. y PÉREZ, H. Caracterización de bacterias y hongos solubilizadores de fosfato bajo tres usos de suelo en el sur del trapecio Amazónico. Acta Biológica Colombiana, 9 (2), 42-45. 2004. [ Links ]
[17] RIVILLAS, C.A. Microorganismos del suelo de la zona cafetera colombiana, su diversidad y valor como controladores biológicos. Foro Internacional Café y Biodiversidad. Chinchiná (Colombia), 2000. [ Links ]
[18] LOPEZ, M. et al. Evaluación de un medio de cultivo no comercial para la producción de un biofertilizante empleado en un cultivo de flores. Tesis Microbiología Industrial. Pontificia Universidad Javeriana, p 70-83. 2006. [ Links ]
[19] HEWITSON, J. and PRICE, R. Plant mineral nutrition in the classroom. School Science Review, 76 (274), 45-55. 1994. [ Links ]
[20] RDRESH D.L., SHIVAPRAKASH, M.K. and PRASAD, R.D. Effect of combined application of Rhizobium, phosphate solubilizing bacterium and Trichoderma spp. on growth, nutrient uptake and yield of chickpea (Cicer aritenium L.). Applied Soil Ecology. 28,139-146. 2004. [ Links ]














