Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.10 no.2 Popayán July/Dec. 2012
CUANTIFICACIÓN DE MERCURIO EN TERMOFORMADOS Y PELÍCULAS FLEXIBLES BIODEGRADABLES ELABORADAS A PARTIR DE YUCA (Manihot esculenta Crantz) POR ESPECTROMETRÍA DE ABSORCIÓN ATÓMICA
QUANTIFICATION OF MERCURY IN THERMOFORMED AND FLEXIBLE FILMS BIODEGRADABLE MADE FROM CASSAVA (Manihot esculenta Crantz) BY ATOMIC ABSORPTION SPECTROMETRY
QUANTIFICAÇÃO DE MERCÚRIO EM TERMOFORMADOS E PELÍCULAS FLEXÍVEIS BIODEGRADÁVEIS ELABORADAS A PARTIR DE MANDIOCA (Manihot esculenta Crantz) POR ESPECTROMETRIA DE ABSORÇÃO ATÔMICA
ROBERTO JULIÁN DEL CASTILLO R.1 , MAITE DEL PILAR RADA-MENDOZA2, OLGA LUCIA HOYOS S.3, HECTOR SAMUEL VILLADA C.4
1 Estudiante de Química, Facultad de Ciencias Naturales, Exactas y de la Educación, Universidad del Cauca.
2 Química, Magíster en Química, Dr. en Ciencias Químicas. Universidad del Cauca, Docente Titular Departamento de Química. Grupo BICAMSA.
3 Lic. en Química, Magíster en Química, Dr. en Ciencias Químicas. Universidad del Cauca, Docente Titular Departamento de Química. Grupo QPN.
4 Ingeniero, Dr. en Ingeniería con énfasis en alimentos. Universidad del Cauca, Docente Titular Departamento de Ing. Agroindustrial. Grupo CYTBIA.
Correspondencia: mrada@unicauca.edu.co
Recibido para evaluación: 09/03/2012. Aprobado para publicación: 22/08/2012
RESUMEN
Se cuantificó el contenido de mercurio en siete muestras de termoformados y seis de películas flexibles biodegradables, por espectrometría de absorción atómica con vapor frío; previamente a ésta cuantificación, se realizó la implementación y estandarización del método analítico, en el cual se determinaron los parámetros de calidad estadística (Límite de detección y de cuantificación, intérvalo lineal, sensibilidad de calibración, precisión y exactitud), que establecieron el rendimiento del método.
Los termoformados se digestaron con una mezcla HNO3:HClO4, relación 3:1, durante 3 horas a 70°C y las películas flexibles por 45 minutos a 50°C. Las muestras se cuantificaron por el método de curva de calibración a 253,7 nm, obteniéndose concentraciones de mercurio en el rango de no detectable a 60 µg/L en termoformados y de no detectable a 6 µg/L en las películas flexibles.
PALABRAS CLAVE: Materiales biodegradables, Yuca, Espectrometría de absorción atómica-vapor frío, Mercurio.
ABSTRACT
The mercury content of seven thermoformed and six biodegradable flexible films samples were evaluated by atomic absorption spectrometry with cold vapor; before the experiments, the statistical quality parameters were implemented and standardized (Detection and quantification limit, linear range, calibration sensitivity, precision and accuracy), who established the performance of the method.
The thermoformed were digested with a mixture HNO3:HClO4, ratio 3:1, by 3 hours at 70°C and the flexible films by 45 minutes at 50°C. The calibration curve at 253.7 nm was the quantification method, obtaining concentrations of mercury in the range from not detectable to 60 µg/L in thermoformed and not detectable to 6 µg/L in the flexible films.
KEYWORDS: Biodegradable materials, Cassava, Atomic absorption spectrometry-cold vapour, Mercury.
RESUMO
Quantificamos o teor de mercúrio em sete amostras de termoformados e seis películas flexíveis biodegradáveis por espectrometria de absorção atômica com vapor frio; antes de esta medida, realizamos a implementação e padronização do método analítico, na qual os parâmetros de qualidade estatística foram determinados (limite de detecção e quantificação, faixa linear, sensibilidade de calibração, precisão e exatidão), que estabeleceu o desempenho do método.
O digestor é termoformado com uma mistura HNO3:HClO4, uma proporção de 3:1 durante 3 horas a 70°C e filmes flexíveis por 45 min a 50°C. As amostras foram quantificadas pelo método da curva de calibração 253,7 nm, resultando em concentrações de mercúrio na faixa de não detectável a 60 mg/L em termoformados e não detectável a 6mg/L em filmes flexíveis.
PALAVRAS CHAVE: Biodegradáveis, Mandioca, Espectrometria de absorção atômica-vapor frio, Mercúrio.
INTRODUCCIÓN
La creciente industria del plástico y el uso indiscriminado de empaques sintéticos, han generado serios problemas ecológicos que contribuyen a la contaminación ambiental, provocada por los desechos sólidos de baja degradabilidad y baja biodisponibilidad; esto ha impulsado a la búsqueda de biopolímeros naturales, en los cuales se aprovechan los recursos naturales como fuente de conservación y reciclaje, convirtiéndose en una excelente opción para el desarrollo de nuevos productos biodegradables [1, 2].
Uno de los principales usos de los biopolímeros, es como empaques para la preservación y protección de todo tipo de productos, siendo los alimentos y las materias primas los de mayor prioridad; estos productos requieren especial atención, dada la contaminación que pueden presentar [1], principalmente por la presencia de metales pesados, los cuales generan una preocupación importante en la salud pública por su toxicidad aguda y/o crónica debido a que no son biodegradables y permanecen durante mucho tiempo en el entorno, biocumulándose [3, 4, 5].
Uno de los metales pesados potencialmente tóxicos es el mercurio, el cual tiene características de persistencia y bioacumulación; aproximadamente un 95% se encuentra en los suelos, en los sedimentos y en todo organismo viviente, alrededor de un 3% en el agua mientras que el 2% restante, existe como vapor en la atmósfera [3]. El mercurio tiene una larga vida media en la atmósfera, lo que le permite viajar grandes distancias y depositarse en otros lugares, lo cual genera problemas de contaminación y representa un riesgo para la salud humana y la de los ecosistemas, ya que puede modificar una gran variedad de células y de procesos bioquímicos; adicionalmente, se ha demostrado que el mercurio interfiere en la síntesis de proteínas y ácidos nucleicos e inhibe varias enzimas citosólicas, afectando el sistema nervioso central [3, 6].
Para que los biopolímeros elaborados a partir de harina y almidón de yuca, fibra de fique, ácido poliláctico, glicerol, entre otros, puedan utilizarse en contacto con los alimentos y/o bebidas, deben ser no tóxicos y degradables, ya que el producto final debe ser ambientalmente asimilable y amigable; sin embargo, durante la obtención de la materia prima y/o en los procesos de elaboración de estos polímeros, pueden adquirir una posible contaminación [7, 8]. La norma técnica colombiana NTC-4096 [9], regula, junto a otros parámetros, la concentración de metales pesados presentes en los empaques, por lo tanto, es de gran importancia realizar la determinación de mercurio y asegurar que los biopolímeros cumplan con los requerimientos especificados para garantizar una buena calidad del producto.
Para tener certeza de la concentración de dichos metales, los análisis se deben realizar mediante técnicas confiables y es por ello que el presente trabajo tuvo como finalidad estandarizar el método para la determinación de mercurio en empaques termoformados (T) y películas flexibles (PF) biodegradables por espectrometría de absorción atómica con atomización por vapor frío.
MÉTODO
Muestra
Los termoformados (MBRA-383, MPER-183, CM 523-7, CM 7951-5, CM 4574-7, NATAIMA 31, HMC 1) y las películas flexibles (SM 707-17 nativo e hidrolizado, SM 1498-4 nativo e Hidrolizado, CM 7138-7 nativo e hidrolizado) biodegradables analizadas, fueron elaboradas y aportadas por el grupo CYTBIA de la Facultad de Ciencias Agropecuarias de la Universidad del Cauca, en el laboratorio de Reología.
Reactivos
Todos los reactivos fueron grado analítico; se empleó una solución madre de mercurio de 1000 mg/L, ácido nítrico al 65%, ácido perclórico al 48%, ácido clorhídrico al 1 y 10%, y solución de borohidruro de sodio (Merck) al 5%, preparadas con agua Milli-Q.
Elaboración de los biopolímeros
El termoformado, material bioplástico semirígido, fue elaborado a partir de harina nativa e hidrolizada de yuca, fibra de fique y plastificantes. Durante su preparación se evaluaron, además de otros parámetros, las diferentes concentraciones de fibra, harina y plastificante, con el fin de obtener adecuadas características mecánicas, térmicas y de adsorción de humedad y su comportamiento estructural, para determinar el envejecimiento de las matrices con respecto a la variedad de yuca usada en las muestras.
Las películas flexibles, fueron elaboradas a partir de almidón nativo e hidrolizado de yuca combinados con ácido poliláctico, policaprolactona, plastificante y agentes acoplantes. De la experiencia desarrollada a nivel de laboratorio se evaluaron, entre otras, las proporciones de los componentes de la mezcla con los cuales se obtuvo la mayor resistencia a la tensión, elongación en el punto de rotura y módulo de elasticidad, y su comportamiento microestructural.
Pre-tratamiento de la muestra
Todas las unidades de cada muestra se llevaron a un tamaño más pequeño mediante el empleo de métodos mecánicos de macerado (termoformados) y cortado (películas flexibles); se conformó una muestra compuesta [10].
Optimización del peso y digestión ácida
Se optimizó el proceso de digestión con ácido nítrico y perclórico [11, 12] (20 mL, mezcla o individualmente cada ácido), variando el peso de la muestra (0,5 1,0 y 2,0 g para termoformados y 0,5 y 1,0 g para películas flexibles), la relación ácido nítrico:ácido perclórico (1:0, 1:1, 1:3, 3:1), el tiempo de digestión (1, 2 y 3 horas para termoformados y 15, 30 y 45 minutos, 1 y 2 horas para películas flexibles) y la temperatura de digestión (35, 50 y 70°C). Una vez digestadas las muestras, se filtraron a través de un crisol de filtración (vidrio Schott Duran porosidad 2), y se almacenaron en recipientes de polietileno a 4°C para su análisis posterior por absorción atómica (Thermo AA S4) [12, 13, 14].
Estandarización del método analítico
Para realizar la estandarización del método analítico, se evaluó la linealidad en el rango de trabajo (2,0 a 20,0 µg de Hg/L) mediante curva de calibración, partiendo de un estándar de mercurio comercial de 1000 µg/L (Merck); se determinaron los límites de detección y de cuantificación [15] preparando tres curvas de calibración, obteniendo la desviación estándar del intercepto (Sb) y el promedio de las pendientes [16, 17].
La precisión fue evaluada en dos niveles: precisión intermedia, que se evaluó con la preparación de siete curvas de calibración durante siete días diferentes, mientras que la repetibilidad se evaluó tras la preparación de cinco curvas de calibración que se analizaron el mismo día; la exactitud del método de extracción se evaluó como el porcentaje de recuperación, adicionando cantidades conocidas del estándar de mercurio (1000 µg/L) a la muestra de termoformado (Nataima 31) y a la muestra de película flexible (CM 7138-7 nativo) antes del proceso de digestión [18, 19].
Cuantificación de mercurio en los biopolímeros
Se utilizó un equipo de absorción atómica (Thermo AA S4) con vapor frío (VP100) [5, 19, 20]. La atomización se realizó en una celda T de cuarzo y se programó con las siguientes condiciones: longitud de onda 253,7 nm, ranura 0,5 nm, altura de mechero 15,2 mm y flujo de nitrógeno de 180 mL/min. La reducción fue realizada con borohidruro de sodio al 0,5% (m/v) en hidróxido de sodio al 0,5% (m/v) y ácido clorhídrico al 10% v/v fue la matriz.
La cuantificación se realizó por curva de calibración, preparando ocho patrones en el rango de 2,0 a 20,0 µg/L en una solución de HCl al 1,0%, a partir de un estándar puro comercial de 1000 µg/L de mercurio (Merck). Todos los análisis fueron realizados por triplicado y los valores correspondieron a las concentraciones promedio en partes por billón [20].
Adicionalmente, se estudió la estabilidad de un estándar (12 µg de Hg/L), una muestra de termoformado diluida (Nataima-31) y de película flexible concentrada (CM 7138-7) nativo durante diez días, para estándar y termoformado y 8 días para película flexible.
Estadística
Los datos de estandarización e implementación se analizaron con el programa estadístico SPSS (versión 11,5) para Windows. Se realizaron las pruebas de normalidad y homogeneidad Shapiro-Wilk y Levene, desviación estándar, coeficiente de correlación y la comparación de medias por análisis de varianza ANOVA de un factor [21, 22], para comparar las medias de las concentraciones y determinar si existían diferencias significativas entre las muestras cuantificadas y para confirmar que el método estandarizado es confiable y reproducible.
RESULTADOS
Optimización del peso y digestión ácida
Los ensayos de digestión de las muestras de termoformados y películas flexibles, dieron como resultado que la mezcla de ácidos nítrico:perclórico en la relación 3:1, dan la mayor eficiencia.
Con respecto al peso, al utilizar 0,5 g de muestra, el mercurio no fue detectable; con 1,0 g se presentó una digestión completa y las muestras fueron detectables y cuantificables. Cuando se usaron 2,0 g de muestra de termoformados, la digestión no destruyó por completo la materia orgánica; una vez establecido el peso, se optimizó el tiempo de digestión que fue de 3 horas para termoformados y de 45 minutos para las películas flexibles; la temperatura óptima fue de 70°C para termoformados y de 50°C para las películas flexibles.
Estandarización del método analítico
Linealidad
La figura 1 muestra la curva de calibración del mercurio, que fue lineal en el rango de concentraciones de 2,0 a 20 µg/L. Se obtuvo un coeficiente de regresión (R) de 0,999, un coeficiente de determinación (R2) de 0,998 y un valor de R cuadrado corregido de 0,998.

El valor de R indicó que los datos tienen un comportamiento lineal; R2 hace referencia a que el 99,8% de la variación observada, se puede explicar por medio de una línea recta, mostrando así que el ajuste es satisfactorio y por lo tanto la relación entre los valores de 'X' (concentración) y 'Y' (absorbancia), se describe adecuadamente por una línea recta; el R cuadrado corregido, indica que el valor se encuentra dentro del parámetro permitido (0,70).
Precisión intermedia
La precisión intermedia fue evaluada tras la lectura de los estándares en siete curvas de calibración (Figura 2), que fueron analizadas en diferentes días, por el mismo analista, en el mismo laboratorio y bajo las mismas condiciones. Los valores obtenidos fueron examinados estadísticamente por medio de los estadísticos de Shapiro-Wilk y Levene, demostrando que los datos son normales y presentan homogeneidad en la varianza.
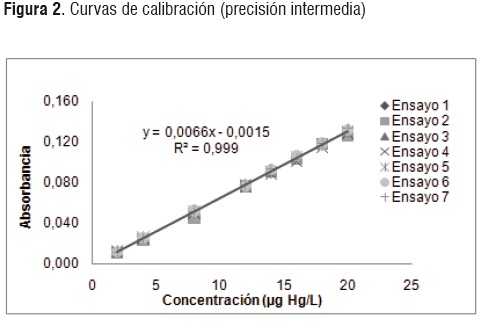
Los niveles de concentración en las curvas de calibración, presentaron una desviación estándar relativa inferior a 0,005 µg Hg/L y un coeficiente de variación menor al 5%, indicando que el método es preciso.
Repetibilidad
La repetibilidad del método completo, se examinó mediante la preparación y análisis de cinco curvas de calibración (Figura 3), las cuales se obtuvieron el mismo día, en el mismo equipo y bajo las mismas condiciones de trabajo. Los datos fueron evaluados mediante las pruebas estadísticas de Shapiro-Wilk y Levene, encontrándose que los valores provienen de una distribución normal y que las varianzas son homogéneas.

Los niveles de concentración en las curvas de calibración, presentan una desviación estándar relativa inferior a 0,004 µg Hg/L, un coeficiente de variación menor al 5%, indicando así que el método presenta repetibilidad.
Sensibilidad analítica
La sensibilidad analítica está dada por la pendiente de calibración, que en este caso son 0,0066 y 0,0067 para la precisión intermedia y repetibilidad, respectivamente; lo anterior indica que para el método se obtiene mayor sensibilidad cuando se trabaja el mismo día.
El límite de detección del mercurio fue de 0,54 µg/L, calculado como la cantidad necesaria para obtener un valor de 3 en la relación señal/ruido. El límite de cuantificación, calculado como la cantidad necesaria para obtener un valor de 10 en la relación señal/ruido fue de 1,79 µg/L.
Exactitud
Para determinar la exactitud del método, calculado como el porcentaje de recuperación del mercurio, se adicionaron cantidades conocidas del estándar de 1000 µg/L de mercurio a las muestras de termoformado (NATAIMA 31) (Cuadro 1) y de película flexible (CM 7138-7 NATIVO) (Cuadro 2).


Se obtuvo porcentajes de recuperación promedio de 97,64% (±0,68) para el termoformado y 94,54% (±0,82) para la película flexible, indicando que el método es adecuado.
Debido a que el valor de recuperación media obtenido se aproxima al 100%, se aplicó un test estadístico (T-student), con el cual se demostró que existen diferencias significativas entre los valores promedio y el 100%, dado que el t tabulado (2,31) fue menor que el t calculado (10,44 para termoformados y 19,94 para películas flexibles).
Determinación de mercurio
Una vez estandarizada la técnica analítica por absorción atómica, se determinó la concentración de mercurio en las muestras de biopolímeros.
En el Cuadro 3 se presentan los resultados obtenidos de la concentración de mercurio en µg/L en los termoformados, donde solo tres muestras fueron cuantificables, con un coeficiente de variación inferior al 6,0%.

Según ANOVA, existen diferencias significativas p<0,05 (p=0,000) entre las tres muestras cuantificables; adicionalmente, el valor de F calculado (1762,575) fue menor que el F tabulado (7,260).
Debido a que hay diferencias significativas entre las muestras, se aplicó la prueba estadística de Tukey para determinar cuáles medias difieren. Se encontró que la muestra 'Nataima 31' difiere de las otras dos con una significancia de 1,000, pero MPER-183 y MBRA-383 tienen la misma significancia con un valor de 0,629. A estas dos muestras se les aplicó la prueba de t-student, y se encontró que existe diferencia significativa entre las dos, dado que el valor de t calculado (8,631) es mayor que el t tabulado (2,78).
En el Cuadro 4 se muestran las concentraciones de mercurio en las películas flexibles; sólo la muestra SM 1498-4 NATIVO fue no detectable.

Los resultados de ANOVA muestran que existen diferencias significativas p=0,05 entre las diferentes muestras de películas flexibles (p=0,00); el F calculado (994,050) fue mayor que el F tabulado (4,468) y se aplicó Tukey, encontrándose que todas las muestras difieren una de otra.
Para determinar la procedencia de esta concentración de mercurio, se realizó la determinación de este elemento en las materias primas (harinas, almidones y fibra de fique) empleadas en la elaboración de cada uno de los termoformados y películas flexibles. En el Cuadro 5, se muestran las concentraciones estimadas de mercurio en MBRA 383, MPER-183, NATAIMA 31, SM 707-17 nativo e hidrolizado, SM 1498-4 HIDROLIZADO y CM 7138-7 nativo e hidrolizado.

En este caso, se puede inferir que el mercurio encontrado en los termoformados y películas flexibles, proviene de las materias primas, principalmente de las harinas y almidones de yuca o la fibra con las que se han fabricado estos biopolímeros; se cree que el mercurio puede llegar a éstas materias primas por absorción de la planta de yuca desde el suelo, ya que este se encuentra en un 95% en este [3, 23]; también puede provenir de los sistemas de riego, donde el agua empleada para dicho fin, puede presentar contaminación por este elemento, lo cual puede ser debido a la actividad minera que se da en la región del pacífico, en donde emplean mercurio para la extracción de oro; sin embargo, los valores indican que estos materiales no serán tóxicos y podrán ser empleados como envolventes y contenedores de alimentos.
Estabilidad
En las figuras 4, 5 y 6, se representa el seguimiento durante 10 días de la estabilidad del estándar de 12,0 µg/L de mercurio, del termoformado (Nataima-31) y de la película flexible (CM 7138-7), para determinar el tiempo de preservación de las muestras.



Se evaluó la normalidad y homogeneidad de los datos y se aplicó ANOVA de un factor. Para la película flexible, no existen diferencias significativas (p>0,05) entre los días analizados (p=0,59), mientras que para el estándar y el termoformado, sí existen diferencias significativas (p<0,05) durante los diez días analizados (p=0,000). De acuerdo a estos resultados, se puede concluir que la muestra de película flexible concentrada, puede guardarse durante ocho días sin presentarse modificaciones en la concentración del metal, mientras que en la muestra que se diluye, lo mejor es analizarla el mismo día, dado que presenta fluctuaciones de concentración en diferentes días; en lo referente al estándar, este también presenta fluctuaciones en la absorbancia, y por tanto, lo mejor es preparar el estándar y analizarlo el mismo día.
CONCLUSIONES
La técnica estandarizada de absorción atómica descrita en este artículo para la cuantificación de mercurio en termoformados y películas flexibles es lineal, precisa, exacta, altamente sensible y por tanto es un método confiable para analizar los polímeros biodegradables.
Las concentraciones de mercurio encontradas en las muestras de termoformados y películas flexibles, están por debajo (<1,0 mg de Hg/L) de las cantidades permitidas para productos que van a estar en contacto con alimentos y podrán ser empleados como envolventes y contenedores de alimentos, sin riesgos para el consumidor; sin embargo, hay que tener cuidado con este elemento, ya que su bioacumulación causa un problema muy grave a nivel medioambiental.
AGRADECIMIENTOS
A la Universidad del Cauca (Laboratorios de BICAMSA, QPN, Reología), al Ministerio de Agricultura y Desarrollo Rural y al CREPIC, por la financiación de los proyectos que enmarcan este trabajo.
REFERENCIAS
[1] VILLADA, H., ACOSTA, H. y VELASCO, R. Biopolímeros naturales usados en empaques biodegradables. Universidad del Cauca, Departamento de Agroindustria, Facultad de Ciencias Agropecuarias. Universidad del Valle. Departamento de Ingeniería de Alimentos, 2007. [ Links ]
[2] MERCHÁN, J., BALLESTEROS, D., JIMÉNEZ, I., MEDINA, J. and ÁLVAREZ, O. Estudio de la biodegradación aerobia de almidón termoplástico (TPS). Suplemento de la Revista Latinoamericana de Metalurgia y Materiales, S1, 39-44, 2009. [ Links ]
[3] HURTADO, R. Determinación de mercurio total en hígado y músculo de tiburones provenientes de las pesquerías de Sonora y Sinaloa, México. Universidad de Sonora. División de ciencias biológicas y de la salud, departamento de investigaciones científicas y tecnológicas. Posgrado en Biociencias, México, 2010. [ Links ]
[4] MORALES, I. y REYES, R. Mercurio y salud en la odontología. Revista Saúde Pública, 37, 2, 266-272, 2003. [ Links ]
[5] RESANO, M., BRICEÑO, J. and BELARRA, M. Direct determination of Hg in polymers by solid sampling-graphite furnace atomic absorption spectrometry, a comparison of the performance of line source and continuum source instrumentation. Spectrochimica Acta Part B, 64, 520–529, 2009. [ Links ]
[6] CARVALHO, C.; CHEW, E., HASHEMY, S., LU, J. and HOLMGREN, A. Inhibition of the human thioredoxin system a molecular mechanism of mercury toxicity. The journal of biological chemistry, 283, 18, 11913-11923, 2008. [ Links ]
[7] OBANIJESU, E. and OLAJIDE, J. Trace Metal Pollution Study on Cassava Flours Roadside Drying Technique in Nigeria. Appropriate Technologies for Environmental Protection in the Developing World, 1, 333-339, 2009. [ Links ]
[8] IDODO-UMEH, G. and OGBEIBU, A.E. Bioaccumulation of the Heavy Metals in Cassava Tubers and Plantain Fruits Grown in Soils Impacted with Petroleum and Non-Petroleum Activities. Research Journal of Environmental Sciences, 4, 33-41, 2010. [ Links ]
[9] NORMA TÉCNICA COLOMBIANA NTC-4096. Plásticos Plastificantes DOP y DOA Grado Alimento. Agosto 30 de 2006. [ Links ]
[10] SCHRIJVER, I., ARAMENDIA, M., VINCZE, L., RESANO, M., DUMOULIN, A. and VANHAECKE, F. Comparison of atomic absorption, mass and X-ray spectrometry techniques using dissolution-based and solid sampling methods for the determination of silver in polymeric samples, Spectrochimica Acta Part B, 62, 1185-1194, 2007. [ Links ]
[11] SANCHES, M. y VILANOVA, E. Técnicas analíticas de contaminantes químicos, Editorial Diaz de Santos, España, p, 12-13, 2004. [ Links ]
[12] VALCÁRCEL, M. Técnicas analíticas de separación. Reverté. 1988. Barcelona. p, 164-165. [ Links ]
[13] BAKKALI, K., RAMOS, N., SOUHAIL, B. and BALLESTEROS, E. Characterization of trace metals in vegetables by graphite furnace atomic absorption spectrometry after closed vessel microwave digestion. Food Chemistry, 116, 590-594, 2009. [ Links ]
[14] NEMATI, K., ABU, NK., BIN, MR., SOBHANZADEH E, and LOW, KH. Comparative study on open system digestion and microwave assisted digestion methods for metal determination in shrimp sludge compost. Journal of Hazardous Materials, 182, 1-3, 2010. [ Links ]
[15] CURRIE, LL. Nomenclature in evaluation of Analytical methods including detection and quantification capabilities, IUPAC, Pure Applied Chemistry, 67, 1699-1723, 1995. [ Links ]
[16] MOCÁK, J., JANIGA, I. and RÁBAROVÁ, E. Evaluation of IUPAC limit of detection and iso minimum detectable value electrochemical determination of lead. Nova Biotechnologica, 9, 91-100, 2009. [ Links ]
[17] IUPAC. Nomenclature in Evaluation of Analytical Methods including Detection and Quantificaction Capabilities. In: Pure and Applied Chemistry, 67, 1699-1723, 1995. [ Links ]
[18] COY, G. Protocolo Estandarización de Métodos Analíticos. Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM), Bogotá. p. 1-10, 1999. [ Links ]
[19] SKOOG, D., HOLLER, F. and NIEMAN, T. Principios de Análisis Instrumental, Quinta edición, McGraw-Hill, Madrid (España), p. 215, 220-225, 2001. [ Links ]
[20] CERVENY, V., RYCHLOVSKY, P., NETOLICKA, J. and SÍMA, J. Electrochemical generation of mercury cold vapor and its in-situ trapping in gold-covered graphite tube atomizers. Spectrochimica Acta, Part B, 62, 317-323, 2007. [ Links ]
[21] SPSS, Statistical Package for the Social Sciences, Version 11.5. 2002. [ Links ]
[22] GUTIERREZ, H. y SALAZAR, R. Análisis y Diseño de Experimentos, Mc Graw Hill, México, p.103-105, 2004. [ Links ]
[23] IDODO-UMEH, G. and OGBEIBU, A. Bioaccumulation of the Heavy Metals in Cassava Tubers and Plantain Fruits Grown in Soils Impacted with Petroleum and Non-Petroleum Activities. Research Journal of Environmental Sciences, 4, 2010, p. 33-41. [ Links ]













