INTRODUCCIÓN
El tomate es la hortaliza de mayor consumo en Colombia y abastece el 59% de la población [1], su vida útil está entre 7 y 10 días en condiciones de almacenamiento de 10-12,5°C y 90-95% de Humedad Relativa, aunque tiende a deshidratarse por ser climatérico. La maduración está acompañada por cambios en el sabor, color, aroma, textura y pérdida de firmeza debido a cambios físicos y químicos asociados con la degradación de la pared celular y la solubilización de las pectinas por las enzimas pectinesterasa (PE), poligalacturonasa (PG) y pectatoliasa (PL) [2]. Debido a su manipulación constante e inapropiada desde el momento de cosecha por el empleo de canastillas plásticas para recolección y transporte, pasando por la selección, clasificación y almacenamiento ocurre contaminación del producto (materiales, cantidad, sobre amontonamiento, etc.) y la aparición de magulladuras, abrasiones, impactos, cortaduras, ataque de insectos que favorecen la aparición de enfermedades causadas por hongos y bacterias tales como Alternaria, Botrytis, Diploidia, Monilia, Penicillium, Phomopsis, Rhizophus, Erwinia y Pseudomonas. Debido a los innumerables elementos que ocasionan pérdidas de calidad, se están generando y usando técnicas y tecnologías pos-cosecha para retrasar la senescencia y mantener la calidad del producto durante un mayor tiempo, como por ejemplo la aplicación de recubrimientos.
Teniendo en cuenta el creciente interés por consumir productos naturales más sanos, seguros y respetuosos con el medio ambiente, se están desarrollando recubrimientos naturales que crean una barrera semipermeable a gases y al vapor de agua al crear una atmósfera modificada que reduce la velocidad de respiración y deshidratación, además de permitir la incorporación de aditivos alimentarios que retardan la aparición de desórdenes fisiológicos [3]. Los recubrimientos deben ser transparentes, estar exentos de sabores, olores extraños, sustancias nocivas para la salud, estables a distintas condiciones de almacenamiento, ser extensibles para que el alimento quede recubierto de forma homogénea y ofrecer resistencia a daños mecánicos leves [4].
El almidón es un componente alimentario utilizado en el mejoramiento de propiedades funcionales y como solución de recubrimiento a partir de materiales como maíz (Zea mays) y yuca (Manihot esculenta Crantz), entre otros. Las limitaciones del almidón nativo disminuyen su funcionalidad por el grado de ramificación, la relación amilosa-amilopectina, distribución del peso molecular, condiciones de pH, temperatura y presión aplicadas, que afectan las propiedades mecánicas, térmicas, estructurales y de barrera, como la disminución de la resistencia a esfuerzos de corte, descomposición térmica, alto nivel de retrogradación y sinéresis [5]. Por esta razón, se realiza la modificación de sus propiedades por vía química, física o biológica como reticulado (cross-linking) con fosfatos o adipatos, pre- gelatinización, dextrinación o hidrólisis ácida [6].
Los ácidos orgánicos son utilizados como reguladores de acidez, agentes antimicrobianos o modificadores químicos de propiedades funcionales del almidón; el ácido cítrico actúa como promotor de enlaces cruzados (reticulación) entre las cadenas y mejora las propiedades mecánicas [7]. Se usó el ácido en la evaluación de un recubrimiento comestible con base en agar y ácido cítrico aplicado en papa fresca, logrando mantener las características sensoriales y de calidad del tubérculo, además de reducir la pérdida de agua con respecto a la muestra testigo después de 25 días de almacenamiento [8].
Se evaluó el efecto de la adición de ácido cítrico en las propiedades de tensión y de barrera en películas elaboradas con base en almidón termoplástico de yuca y su posible acción microbiológica sobre dos hongos causantes de daños en el tomate.
MÉTODO
El proyecto se desarrolló en las instalaciones de la Planta Piloto para el procesamiento de vegetales, Laboratorios de Biotecnología, Reología y Empaques de la Facultad de Ciencias Agrarias de la Universidad del Cauca y en la Unidad de Microscopía Electrónica ubicada en el Museo de Historia Natural, en la ciudad de Popayán, Colombia, a una altitud de 1.738 msnm, temperatura media de 19°C y Humedad Relativa (H.R) del 77,75%.
Materiales
Se usaron tomates larga vida variedad Indaba en grado 4 de madurez, diámetro ecuatorial promedio de 8 cm y axial de 6 cm, producidos bajo cubierta y cultivados en la finca “El Porvenir” de la vereda Cinco Días, Municipio de Timbío (Cauca), con altura promedio de 1.850 msnm, temperatura media entre 16 y 23°C. Se usó almidón nativo de yuca variedad SM 707-17 proveniente de la rallandería “La Agustina” ubicada en Mondomo (Cauca) y almidón de yuca SM 707-17 modificado enzimáticamente con alpha - amylasa Bacillus amyloliquefaciens Ban 240L (Sigma Aldrich), con grado de modificación del 10% de Equivalente de Dextrosa (E.D.) [9].
Se requirió ácido cítrico monohidrato grado analítico con pureza del 99,5%, marca Carlo Herba, para realizar la modificación del almidón de yuca por vía ácida; aceite esencial de limoncillo (Cymbopogon citratus) de grado alimentario, por sus propiedades antimicrobianas y antibacteriales; glicerina como plastificante no volátil de bajo peso molecular que mejora la flexibilidad, manejabilidad y habilidad de extensión del recubrimiento [10]; Tween 80, aditivo alimentario con acción surfactante para facilitar o aumentar la emulsividad, dispersión y adherencia del recubrimiento [11].
MÉTODO
Modificación del almidón con ácido cítrico
El almidón en suspensión de 100 g al 40% p/p en base seca se hidrató por 1 hora; se midió pH inicial (5,5) y se llevó a agitación de 175 rpm con temperatura de 52°C en el Shaker Thermo Scientific; cuando la suspensión alcanzó los 52°C, se adicionó ácido cítrico (15%), nuevamente se midió el pH y se colocó en el shaker a las mismas condiciones durante 14 h. Al finalizar este tiempo se ajustó el pH 5,5 por neutralización con NaOH 3N y 1N.
Se transfirieron las suspensiones a tubos falcon para centrifugar a 4500 rpm por 30 min (establecido por preliminares) y obtener el sobrenadante para medir ED en el espectrofotómetro UV marca SHIMADZU 1800 [5], procedimiento seguido para el almidón con 25% p/p en base seca y las concentraciones de ácido cítrico, evaluando por separado las concentraciones de NaOH.
Acondicionamiento del fruto
Se seleccionaron tomates larga vida en estado 4 de madurez, redondos, sanos e inocuos, firmes y jugosos, enteros, con apariencia lisa, sin grietas o quemaduras de sol, sin daños mecánicos o producidos por insectos [12], lavados por inmersión en agua potable y desinfección con solución de hipoclorito de sodio a 5 ppm durante 15 minutos y secados con toalla absorbente [4].
Modificación del almidón
Se obtuvo una suspensión de 100 g usando 25% p/p de almidón en base seca y ácido cítrico grado analítico al 15% p/p en base seca [13] con ayuda del Shaker Thermo Scientific a 52°C, 175 rpm con tiempo de modificación de 14 horas , luego de 14 horas se centrifugó a 4500 rpm por 30 min, se eliminó el sobrenadante y se secó el almidón en el horno, iniciando con una temperatura de 20°C, con aumentos progresivos de 5°C hasta llegar a 45°C (establecido en pruebas preliminares) y humedad de 12% [14].
Preparación y aplicación del recubrimiento
Se realizó una pre-mezcla de los componentes del recubrimiento (agua, glicerol, almidón de yuca, aceite esencial, tween 80) a 300 rpm y 40°C, se calentó desde 40 hasta 75°C por 10 min hasta la gelatinización del almidón durante 15 min [15].
Crecimiento microbiano
Se identificaron los especies de hongos que atacan al tomate, realizando 5 aislamientos a partir del fruto contaminado naturalmente, proporcionándole el medio de cultivo. Se cortaron 4 trozos de tejidos de tomate enfermo y sano, de 1 cm2 de área y de 2 mm de grosor; a cada muestra se le realizaron 4 enjuagues por 1 minuto cada uno, el primero con hipoclorito al 1%, el segundo con etanol al 75%, el tercero y el cuarto con agua destilada estéril. Se secaron en papel absorbente estéril, se sembraron en agar PDA y se incubaron a 25°C por dos días; cuando se observó el crecimiento de los hongos se aislaron 4 muestras de cada caja de Petri en PDA, cortando pequeñas muestras del cultivo de aproximadamente 0,25 mm2, que se re sembraron en PDA, iterativamente hasta obtener un cultivo puro [16].
Para medir la estructura de la epidermis del tomate recubierto, se utilizó Microscopio Óptico de Alta Resolución (MOAR) Marca Nikon modelo Microphot y un Microscopio Electrónico de Transmisión (MET) Marca JEOL, modelo JEM 1200EX. Las muestras de 5 mm de longitud y 1 mm de grosor se fijaron en glutaraldehído al 6% y paraformaldehído al 4% en Buffer de Fosfato Salino (PBS) [17], con modificaciones.
Se utilizó un diseño factorial 4x6 completamente al azar, donde los factores fueron “Tipo de recubrimiento” con 4 niveles (tratamientos T1 a T4) y “Tiempo” con 6 niveles (Días 0, 3, 6, 9, 12 y 15) denominados PI, D3, D6, D9, D12, D15, respectivamente.
T1= Muestra Testigo (tomate sin recubrir)
T2= Recubrimiento con almidón de yuca modificado enzimáticamente
T3= Recubrimiento con almidón de yuca modificado con ácido cítrico
T4= Recubrimiento con almidón de yuca nativo.
Se realizaron tres réplicas con cuatro repeticiones por cada tratamiento, tomando 30 unidades experimentales por réplica. Los resultados obtenidos fueron evaluados por pruebas paramétricas (ANOVA), no paramétricas y paramétricas con medidas repetidas; con una probabilidad de 95% empleando el software SPSS versión 19.
RESULTADOS
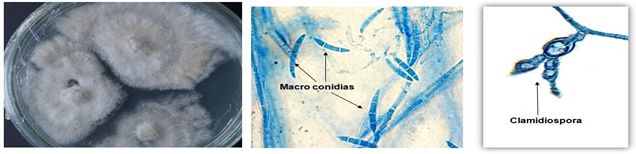
Después del aislamiento, se hizo seguimiento al crecimiento del hongo, observando sus esporas y características específicas macro morfológicas como color, superficie, borde, consistencia, aspecto y desarrollo; también, se caracterizaron los hongos de forma micro morfológica, teniendo en cuenta estructuras reproductivas, presencia de hifas y la formación de esporas, conidias y la forma del micelio que permiten la identificación del hongo que inicia la degradación del fruto.
Características macro morfológicas y descripción microscópica de hongos que inician el deterioro y degradación en el fruto de tomate
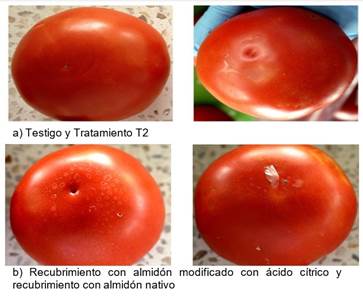
Durante este periodo se evaluó la sintomatología por área afectada en los tomates (Cuadro 1) evidenciando que Colletotrichum sp. causó mayor daño que Fusarium sp., sobre los tejidos del tomate deteriorando el exocarpo, luego en el mesocarpo y con pudrición al final (Día 15) en el endocarpo (Figura 1), apareciendo pequeñas manchas húmedas en el (Día 6), hundidas y de forma circular que se asemejan a las depresiones dejadas por objetos redondos causados por los hongos [16].
Cuadro 1 Resumen de datos de patogenicidad de Colletotrichum sp. y Fusarium sp., por cada tratamiento utilizado.
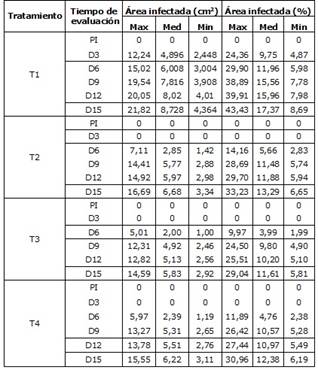

Figura 1 Características macromorfológicas (anverso), microfotografía y aspecto del Colletotrichum sp en el fruto
En esas colonias crecientes de Colletotrichum sp se denota que parte central se ennegrece y endurece ligeramente debido a los acérvulos negros que se desarrollan por debajo de la epidermis del fruto. Y para Fusarium sp.,con un micelio generalmente aéreo, abundante, algodonoso y con coloración variable de blanco a rosado durazno [16], con conidióforos variables, escasos y simples o corpulentos cortos con ramificaciones irregulares, conidias hialinas, macroconidias ovoides (Figura 2). Las manchas al pasar el tiempo se hacen numerosas y coalescentes, producen primero el ablandamiento acuoso del fruto y por ultimo su pudrición, que es acelerada por otros microorganismos.
Inhibición de los hongos
Durante los dos primeros días de tratamiento el tratamiento T2 reveló mayor consumo de O2, mientras que los tratamientos T1 y T4 mantuvieron
mayores valores en la velocidad de respiración a partir del día 3 respecto a los demás tratamientos a causa del incremento en la actividad metabólica [18], este incremento en la variable de respuesta concuerda con los resultados obtenidos por [19], que encontraron incrementos notorios en la tasa de respiración en tomates sin recubrir lo que atribuyen a la difusión libre de gases como O2 y CO2; el incremento de la tasa de respiración conduce a la maduración propia del fruto.
Es importante mencionar que al final del estudio, los frutos de todos los tratamientos presentaron diferentes niveles de deterioro, en donde una de las razones por las cuales los recubrimientos probablemente no inhibieron completamente el crecimiento de microorganismos son porque al parecer los hongos que inician el deterioro permanecen en el fruto desde etapas tempranas en el cultivo y que solo se desarrollan por cambios fisiológicos dados por la etapa de maduración; y puede deberse a la escasa adherencia de los recubrimientos sobre los frutos no permitió formar una capa uniforme que restringiera el desarrollo de especies fúngicas como ha sido reportado por [20].
Durante de estudio con el paso del tiempo, el ablandamiento de los frutos, las manchas se extienden hasta alcanzar un porcentaje de infección con el T1 entre 24,36 y 43,43% ya que los tomates no tenían recubrimiento por lo tanto los poros de la epidermis se hacen más suceptibles al ataque por microorganismos [21], en este caso causados por Colletotrichum sp., y Fusarium sp., con el tratamiento T2 el entre 14,16 y 33,23% de área infectada, presentando menor inhibición de microorganismos, dado que su maduración fue prematura respecto a los demás, lo que se pudo notar de manera cuantitativa en el consumo de O2 y liberación de CO2 y de manera cualitativa en la acelerada aparición de hongos, pues en el día 6 ya se habían desarrollado en algunos frutos (Figura 3); a partir de este momento, el hongo evolucionó hasta desintegrarse en el fruto causando olores desagradables y exudación de líquidos, mientras que los frutos tratados con ácido cítrico fueron atacados tres días después que los otros tratamientos con un porcentaje de área afectada entre 9,97 y 29,04%, puede deberse al potencial inhibitorio del ácido cítrico al degradar en enzimas celulolíticas y pectinolíticas de los hongos [22,23].
Con el tratamiento el T4 se evidenció un comportamiento similar al de T3, con áreas afectadas entre 4,76 y 12,38%.
Microscopía Óptica de Alta Resolución (MOAR)
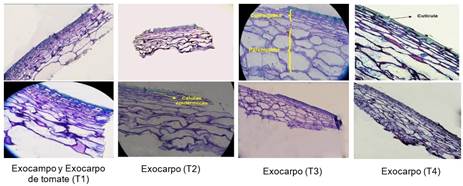
La muestra testigo y la recubierta con almidón nativo presentaron cutícula delgada, de color azul agua marina intenso, células epidérmicas achatadas y parénquima con grosor mayor que el de las células epidérmicas, frente a otros cortes de exocarpo a los cuales se les aplicó recubrimiento con almidón modificado enzimáticamente y con ácido cítrico, en los cuales se generó un ensanchamiento de la cutícula del exocarpo [23], y de la capa de colénquima, debido a que la cutícula no es impermeable al presentar porosidades que facilitan el ingreso de compuestos polares y apolares, lo que permite inferir que pequeñas partes acuosas del recubrimiento penetraron la cutícula provocando el ensanchamiento de la células epidérmicas y colenquimatosas [24]. Los tomates a los cuales se les aplicó recubrimiento de almidón modificado con ácido cítrico, presentaron una apariencia con aumento en el tamaño de las células del exocarpo en forma circular frente a las demás muestras (Figura 4).
Debido a la falta de estudios que relacionen la introducción de recubrimientos (de almidón de yuca) en células epidérmicas de tomate, se intuye que la modificación (enzimática o por vía ácida), produce una disminución en la viscosidad del almidón, lo que hace más fácil la penetración del recubrimiento hacia el interior de las células epidérmicas [21]. Se encontró una diferencia entre las imágenes del exocarpo de los tratamientos T2 y T3; en este último, la capa de colénquima presentó mayor tamaño con células redondeadas (respecto a T2), lo que significa que a través del mesocarpo se dio una transmisión de componentes presentes en el recubrimiento.
Microscopía Electrónica de Transmisión (MET)
Se obtuvieron imágenes en las que se pudo apreciar la sección de la cutícula y las células epidémicas, corroborando lo observado en las imágenes de MOAR (Figura 5).
CONCLUSIONES
De forma cualitativa se estableció que los frutos del tratamiento T3 presentaron retraso de 3 días en la maduración y en el ataque por hongos, por lo que se concluye que el ácido cítrico se puede añadir como agente conservante en recubrimientos y no como modificador de almidón para uso en los mismos, dado que se necesita una enorme cantidad para lograr mayor viscosidad.
Con la Microscopía Óptica de Alta Resolución (MOAR) y Microscopía Electrónica de Transmisión (MET), se observaron las diferencias en las células epidérmicas del exocarpo de tomate, siendo el recubrimiento con almidón modificado con ácido cítrico el que produjo mayor ensanchamiento de las células epidérmicas.