Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista EIA
Print version ISSN 1794-1237On-line version ISSN 2463-0950
Rev.EIA.Esc.Ing.Antioq no.16 Envigado July/Dec. 2011
INMUNOSENSOR PIEZOELÉCTRICO PARA LA DETECCIÓN DEL METABOLITO 3,5,6-TRICLORO-2-PIRIDINOL DEL PLAGUICIDA CLORPIRIFOS
PIEZOELECTRIC IMMUNOSENSOR FOR THE DETECTION OF 3,5,6-TRICHLORO-2-PYRIDINOL METABOLITE OF THE PESTICIDE CHLORPYRIFOS
INMUNOSENSOR PIEZOELÉCTRICO PARA A DETECÇÃO DO METABOLITO 3,5,6-TRICLORO-2-PIRIDINOL DO PESTICIDA CLORPIRIFOS
Aquiles Ocampo1, Marisol Jaramillo2, Carmen March3, Ángel Montoya4
1 Ingeniero Químico, Universidad de Antioquia; Magíster y Doctor en Ingeniería Química, University of Kentucky, Profesor titular e investigador del grupo GPC, Escuela de Ingeniería de Antioquia. Medellín, Colombia. investigar@eia.edu.co
2 Ingeniera Química, Magíster en Ciencias-Biotecnología y Doctora (c) en Biotecnología, Universidad Nacional de Colombia, Sede Medellín. Profesora Asistente e Investigadora del grupo Gibec, Escuela de Ingeniería de Antioquia. Medellín, Colombia. pfmarisol@eia.edu.co
3 Licenciada en Ciencias Biológicas y Doctora en Ciencias Biológicas, Universidad Politécnica de Valencia, España. Investigadora, Instituto Interuniversitario de Investigación en Bioingeniería y Tecnología Orientada al Ser Humano (I3BH), Universitat Politècnica de València. Valencia, España. cmarch@ginmuno.i3bh.es
4 Licenciado y Doctor en Ciencias Químicas, Universidad de Valencia, España. Investigador y director, Instituto Interuniversitario de Investigación en Bioingeniería y Tecnología Orientada al Ser Humano (I3BH) y Profesor Titular, Universitat Politècnica de València. Valencia, España. amontoya@ginmuno.i3bh.es
Artículo recibido 5-VII-2011. Aprobado 21-IX-2011
Discusión abierta hasta junio de 2012
RESUMEN
La detección y el seguimiento analítico del insecticida organofosforado clorpirifos son necesarios a fin de que sus niveles no sobrepasen los límites permitidos por diferentes normas de organismos reguladores. En este trabajo se presenta un inmunosensor piezoeléctrico que puede determinar y cuantificar el 3,5,6-tricloro-2-piridinol (TCP), el principal metabolito del clorpirifos y del herbicida triclopir. El análisis y cuantificación del TCP se basa en un inmunoensayo competitivo con anticuerpo monoclonal. Para ello se inmovilizó, con enlace covalente, el conjugado de hapteno BSA-TS1 para TCP, sobre la superficie del electrodo de oro del cristal piezoeléctrico de cuarzo. Esta unión covalente a la superficie sensora se realizó mediante la formación de monocapas autoensambladas simples y mixtas (SAM y MSAM)). Se obtuvieron curvas patrón de calibración con cristales inmovilizados con ambos tipos, SAM y MSAM, y se compararon los resultados. Los valores de límite de detección (LOD) y el rango de trabajo obtenidos usando SAM simples fueron de 16 y 25-100 μg/L respectivamente, mientras que los valores obtenidos para estos dos parámetros empleando MSAM fueron de 9,5 y 18-74 μg/L respectivamente. En ambos casos, el cristal podía usarse alrededor de 100 ensayos sin pérdida apreciable de sensibilidad.
PALABRAS CLAVE: clorpirifos; QCM; SAM; TCP; anticuerpo monoclonal.
ABSTRACT
Detection and monitoring of the organophosphate insecticide chlorpyrifos are required to comply with the limits allowed under different laws of regulatory agencies. Here we report on a piezoelectric immunosensor which can determine and quantify 3,5,6-trichloro-2-pyridinol (TCP), the main metabolite of chlorpyrifos and the herbicide triclopyr. The analysis and quantification of TCP is based on a competitive immunoassay with monoclonal antibody. Therefore, BSA-TS1hapten-conjugate for TCP was attached by a covalent bond to the gold electrode of a quartz crystal by means of both, simple and mixed self-assembled monolayers (SAM and MSAM). Standard calibration curves were obtained with both types, SAM and MSAM, and results were compared. For simple SAM the limit of detection (LOD) and working range obtained were 16 and 25-100 μg/L, respectively, whereas for MSAM were 9.5 and 18-74 μg/L, respectively. In both cases, the crystal may be used for about 100 tests without appreciable loss of sensitivity.
KEY WORDS: chlorpyrifos; QCM; SAM; TCP; monoclonal antibody.
RESUMO
A detecção e o rastreamento analítico do inseticida organofosforado clorpirifos são necessários a fim de que seus níveis não ultrapassem os limites permitidos por diferentes normas de organismos reguladores. Neste trabalho apresenta-se um imunosensor piezoeléctrico que pode determinar e quantificar o 3,5,6-tricloro-2-piridinol (TCP), o principal metabolito do clorpirifos e do herbicida triclopir. A análise e quantificação do TCP baseiam-se em um imunoensaio competitivo com anticorpo monoclonal. Para isso se imobilizou, com enlace covalente, o conjugado de hapteno BSA-TS1 para TCP, sobre a superfície do eletrodo de ouro do cristal piezoeléctrico de quartzo. Esta união covalente à superfície sensora realizou-se mediante a formação de monocapas autoensambladas simples e mistas (SAM e MSAM). Obtiveram-se curvas padrão de calibração com cristais imobilizados com ambos os tipos, SAM e MSAM, e se compararam os resultados. Os valores de limite de detecção (LOD) e faixa de trabalho obtidos usando SAM simples foram de 16 e 25-100 μg/L respectivamente, enquanto os valores obtidos para estes dois parâmetros, mas empregando MSAM foram de 9,5 e 18-74 μg/L respectivamente. Em ambos os casos, o cristal podia ser usado ao redor de 100 ensaios sem perda apreciável de sensibilidade.
PALAVRAS-CHAVE: clorpirifos; QCM; SAM; TCP; anticorpo monoclonal.
1. INTRODUCCIÓN
La detección y el análisis del clorpirifos son necesarios para controlar que sus niveles se ajusten a los límites permitidos por las legislaciones de diferentes organismos reguladores. Así por ejemplo, la Unión Europea ha limitado estrictamente las emisiones, vertidos y pérdidas de clorpirifos por medio de la Directiva Nº 2455/2001/EC, que incluye una lista de 33 sustancias peligrosas prioritarias (European Parliament, 2001). Esto hace necesario el desarrollo de métodos rápidos, de bajo costo, con detección en línea y con dispositivos de análisis en campo que puedan funcionar sin supervisión. Como una propuesta promisoria de solución se presenta la tecnología de los biosensores, específicamente la modalidad de los inmunosensores piezoeléctricos que corresponden a uno de sus tipos especiales (Montoya, Ocampo y March, 2008).
El clorpirifos es un insecticida organofosforado de amplio espectro que se utiliza para el control de mosquitos, moscas, cucarachas, pulgas y termitas en las viviendas, y en agricultura y salud para combatir diversas plagas de los cultivos presentes en el suelo o en las hojas y combatir larvas acuáticas. También se utiliza para el control de ectoparásitos en ganado bovino y ovino. El TCP o 3,5,6-tricloro-2-piridinol es el principal metabolito del insecticida clorpirifos y del herbicida triclopiri; se encuentra en la orina humana.
El clorpirifos puede causar inhibición de la colinesterasa en los seres humanos, lo cual implica que se puede sobreestimular el sistema nervioso, causando náuseas, mareos, confusión, y en exposiciones demasiado altas (por ejemplo, por accidentes o por derrames grandes), parálisis respiratoria y muerte (FAO/WHO, 1983). Además, de acuerdo con la EPA de los Estados Unidos, la exposición al clorpirifos representa un grave problema para las mujeres embarazadas y niños pequeños, causando efectos neurofisiológicos (Agency for Toxic Substances and Disease Registry, 2011).
Existe una amplia variedad de métodos analíticos descritos en la literatura para la identificación y cuantificación de pesticidas, la mayoría de ellos demasiado costosos o demorados para la entrega de los resultados. Los métodos estandarizados de análisis tales como cromatografía de gases (GC), cromatografía líquida (LC) y cromatografía líquida de alta presión (HPLC), junto con sus detectores selectivos (espectrómetro de masas, de captura de electrones, de fotometría de llama o detectores de arreglo de diodo) han sido usados para la determinación eficaz de clorpirifos y sus metabolitos. Sin embargo, estos métodos requieren mucho tiempo y un trabajo preparativo previo de las muestras como la extracción con disolventes y la limpieza de los extractos (Sanz et al., 1991; Hiemstra y De Kok, 1994).
Para resolver estos problemas surgen las técnicas inmunonalíticas que emplean anticuerpos específicos para la detección de contaminantes medioambientales, como los plaguicidas, de manera sencilla, rápida, selectiva y sensible. Los inmunoensayos, por ejemplo el formato ELISA, son considerados como de bajo costo y complementarios de los métodos cromatográficos. Sin embargo, requisitos tales como períodos de incubación largos y repetidos lavados dificultan su automatización para el análisis periódico de muestras (Manclús y Montoya, 1995; Banks y Hernández, 2003). En cambio el biosensor piezoeléctrico detecta rápidamente y de manera reversible la presencia de contaminantes ambientales por medio de un inmunoensayo que no necesita marcaje (cosa que sí requiere el ELISA) y permite la detección directa (Jiang et al., 2008).
El uso de cristales piezoeléctricos como elementos transductores en el desarrollo de biosensores microgravimétricos tiene su origen en los trabajos de Sauerbrey hace ya algunas décadas (Sauerbrey, 1959). Sus estudios demostraron que, bajo ciertas condiciones, la variación de la frecuencia de resonancia de un cristal piezoeléctrico presenta un comportamiento lineal con la densidad de masa superficial depositada sobre él. Aunque el entorno líquido afecta la frecuencia de resonancia del cristal (Kanazawa y Gordon, 1985), se ha demostrado (Arnau, Jiménez y Sogorb, 2000) que si el medio en que se halla inmerso el sensor puede considerarse semiinfinito, exponiéndose sólo una cara del sensor al entorno de ensayo, la variación de frecuencia del resonador corresponde a la suma de las contribuciones debidas al líquido y a la capa de recubrimiento. En consecuencia, si las características de densidad y viscosidad del medio fluido se mantienen constantes, la variación de frecuencia sigue el mismo comportamiento lineal establecido por Sauerbrey, siempre que la capa de recubrimiento pueda considerarse rígida (Ocampo, March y Montoya, 2007).
Se denomina monocapa autoensamblada (SAM) a un recubrimiento monomolecular que se realiza sobre una superficie sólida. Estas monocapas, por sus propiedades tanto físicas como químicas, constituyen una herramienta muy útil para la inmovilización de biomoléculas mediante enlace covalente sobre la superficie sensible del biosensor. Entre los compuestos más comunes en la formación de SAM figuran los alcanotioles, los cuales en disoluciones etanólicas diluidas se adsorben espontáneamente al oro del electrodo del cristal piezoeléctrico (García, 2009).
Las monocapas autoensambladas mixtas (MSAM) se forman generalmente por la coadsorción de mezclas de dos tioles; uno de ellos proporciona el grupo funcional (como un ácido carboxílico) a una fracción molar baja, y el otro, que es conocido como diluyente (un tiol), tiene una fracción molar alta. El tiol reduce la concentración en la superficie de los grupos funcionales a los que se unirá la proteína por medio de enlace covalente, reduciendo así al mínimo los impedimentos estéricos, la desnaturalización parcial de la proteína y las interacciones no específicas que pudieran producir interferencias. También el tiol diluyente se puede utilizar para aportar otras propiedades físico-químicas a la interfaz (como su carácter hidrofóbico / hidrofílico) (Briand et al., 2006).
Este trabajo hace parte de una investigación tendiente a desarrollar inmunosensores piezoeléctricos para el análisis de plaguicidas y busca determinar si el empleo de recubrimientos MSAM permite disminuir los límites de detección comparados con los obtenidos mediante los recubrimientos SAM. Esto no solamente es importante para detectar cantidades mínimas de contaminantes, sino que permitiría rebajar la cantidad de anticuerpos utilizados y la de los conjugados de hapteno, los cuales tienen un costo apreciable en su preparación; para lograrlos se usó como compuesto modelo el metabolito TCP.
2. METODOLOGÍA EXPERIMENTAL
2.1 Materiales y reactivos
Los productos químicos utilizados en la inmovilización de sensores de superficie fueron suministrados por Sigma-Aldrich de los Estados Unidos, entre ellos el ácido tióctico (TA), la N-hidroxisuccinimida (NHS), el 1-etil-3 (-3 dimetilamino-propil) clorhidrato de carbodiimida (EDC), el agente bloqueador clorhidrato de etanolamina, la albúmina de suero bovino (BSA), el Tween 20 (T20), los disolventes orgánicos etanol y acetona y las sales inorgánicas.
Los inmunorreactivos para el análisis de TCP (conjugado de ensayo BSA-TS1 y anticuerpo monoclonal LIB-MC2) fueron producidos en los laboratorios del Grupo de Inmunotecnología de la Universidad Politécnica de Valencia (UPV), según procedimiento reportado anteriormente (Manclús y Montoya, 1996).
El 11-mercaptoundecanol (MUD), el ácido 16-mercaptohexadecanoico (MHA) y el clorpirifos fueron suministrados por la UPV; a su vez la UPV obtuvo el clorpirifos de Dr. Ehrenstorfer GmbH, Augsburgo, Alemania. Los estándares fueron preparados a partir de una solución madre (1 mM) en dimetilformamida (DMF) seca y almacenada a -20 °C, por dilución en PBST (tampón fosfato salino 10 mM, pH de 7,45 con 0,005% del surfactante Tween 20).
2.2 Procedimiento de inmovilización
El conjugado de hapteno BSA-TS1 se inmovilizó sobre el electrodo de oro del cristal por enlace covalente mediante la formación de SAM y MSAM. La densidad molecular que se logra con las MSAM confiere estabilidad a la capa y proporciona un control fiable sobre la inmovilización del conjugado de hapteno (Ferreti et al., 2000). Para lograr el enlace covalente entre el derivado de hapteno y la superficie del sensor en condiciones no desnaturalizantes, se recurrió al acoplamiento con carbodiimida (Grabarek y Gergely, 1990).
El proceso de inmovilización del conjugado de TCP en el electrodo se llevó a cabo en varias etapas. En primer lugar, se lavó la superficie de oro del cristal de cuarzo con una mezcla oxidante conocida como solución piraña (H2SO4 concentrado y H2O2 al 30%, 3:1 v:v) durante 5 minutos a temperatura ambiente, para destruir los posibles contaminantes orgánicos y garantizar una superficie inerte. Se lavó tres veces el cristal con agua bidestilada y etanol y se secó con gas nitrógeno.
Para la preparación de las SAM, el electrodo se puso en contacto con una disolución 10 mM de ácido tióctico en etanol. En el caso de la formación de las MSAM, se utilizó una mezcla, en una proporción 3:1 (v/v), de dos tioles: el MUD y el MHA a una concentración final de 10 mM en etanol. Tanto las disoluciones de TA como las de la mezcla MUD/ MHA 3:1, reaccionaron durante toda la noche para la formación de las SAM y las MSAM, respectivamente. Después los electrodos se lavaron exhaustivamente con etanol para eliminar el exceso de alcanotiol.
La activación del grupo carboxílico en un reactivo intermedio (éster de N-hidroxi-succinimida) se llevó a cabo utilizando una mezcla de N-hidroxisuccinimida (NHS) y EDC. Este intermediario forma enlace covalente con los grupos amino de los conjugados hapteno-proteína usados como elementos de reconocimiento. Por último, se añadió etanolamina, con el fin de bloquear todos los ésteres NHS que pudieran haber quedado en la superficie del sensor y que no hubiesen reaccionado para formar el enlace covalente. Este procedimiento evita interacciones inespecíficas con otras proteínas después de la interacción con el conjugado (Duan y Meyerhoff, 1995; Disley et al., 1998; Susmel, Guilbault y O'Sullivan, 2003; Briand et al., 2006; Mauriz et al., 2006a, 2006b).
Para activar los grupos carboxílicos, mediante la formación de ésteres, la superficie sensora se sumergió en una solución de EDC (200 mM) y N-hidroxisuccinimida NHS (50 mM) en etanol y se dejó reaccionar durante 4 horas a temperatura ambiente. El EDC convierte el ácido carboxílico del alcanotiol en un reactivo intermedio (ésteres de N-hidroxisuccinimida) que reacciona con el grupo amino libre del conjugado y, por lo tanto, se produce el acoplamiento covalente del conjugado de hapteno a la superficie del sensor. Finalmente la inmovilización mediante enlace covalente del conjugado BSA-TS1 se llevó a cabo por medio del enlace entre los grupos amino de la proteína (BSA) y los grupos activos NHS-éster de la monocapa. Para ello, sobre la superficie sensora del cristal, se depositaron 60 μL de una disolución de 10 mg/ml de conjugado y se dejó reaccionar durante 5 horas a temperatura ambiente. Posteriormente se lavó, primero con tampón fosfato sódico 0,1M, pH 7,5 y después con tampón borato Na 0,1M, pH 8,75. Los grupos NHS activos que no reaccionaron con el conjugado se bloquearon con 60 μL de etanolamina 0,1 M en tampón borato por una hora a temperatura ambiente. Por último, se lavó el cristal inmovilizado con agua bidestilada, se secó al aire y se guardó a 4 °C.
2.3 Transductor piezoeléctrico y sistema de medida
El analizador de señales de la microbalanza de cristal de cuarzo (ACC-QCM-09), las celdas de flujo y algunos de los cristales de cuarzo fueron suministradas por AW Sensors de España (www.awsensors.com); otros cristales de cuarzo fueron suministrados por International Crystal Manufacturing Company (www.icmfg.com) y la microbomba peristáltica fue proporcionada por Cole Parmer (www.coleparmer.com), los dos últimos de los Estados Unidos. Las dimensiones de los cristales de cuarzo con electrodos de oro fueron: 0,167 mm de espesor, 5 mm de diámetro y 0,196 cm2 de área efectiva.
Una vez químicamente funcionalizado, el cristal piezoeléctrico de cuarzo fue colocado y sellado en una celda de flujo, sellada a su vez con dos anillos de nitrilo, para que así solamente una de las caras del cristal pueda estar en contacto con los reactivos durante los análisis. La celda (volumen interno 50 μL) fue incluida en un sistema de flujo constante a una velocidad de 60 μL/min, controlado a su vez por una bomba peristáltica, como se detalla en la figura 1.
Las medidas de la frecuencia y de la resistencia durante los análisis se hicieron en la microbalanza de cristal de cuarzo (ACC-QCM-09), el cual es un sistema que proporciona la medida de los efectos de variación en la masa del cristal, y se basa en la técnica de la cancelación de la capacitancia y fue diseñada para los usos de la investigación.
2.4 Análisis de datos
Las curvas patrón normalizadas se obtuvieron representando la disminución de la frecuencia contra el logaritmo de la concentración del analito. Los puntos experimentales se adaptaron a la ecuación logística de cuatro variables:
y = D + (A-D)/[1 + (x/C)B]
donde A es el valor asintótico máximo (señal máxima en la ausencia del analito, Δfmáx), B es la pendiente de la curva en el punto de inflexión (relacionado con la concentración del analito que proporciona un 50% de inhibición de Δfmáx: C, I50) y D es el mínimo asintótico (Ocampo, March y Montoya, 2007).
2.5 Procedimiento del inmunoensayo
Los inmunoensayos desarrollados para la determinación del insecticida fueron pruebas de inhibición basadas en el procedimiento de conjugado inmovilizado, en el cual el hapteno conjugado fue inmovilizado mediante enlace covalente sobre la superficie del sensor. Para los análisis de inhibición, una cantidad fija del anticuerpo monoclonal fue mezclada con soluciones patrón del analito, y la mezcla se bombeó sobre la superficie del sensor. Puesto que los analitos inhiben la unión del anticuerpo a los conjugados inmovilizados respectivos, el aumento en las concentraciones del analito reducirá el decremento de frecuencia del sensor piezoeléctrico.
Se prepararon diversas concentraciones patrón del insecticida por medio de diluciones seriadas en dimetilformamida (DMF). Los patrones fueron mezclados con una concentración fija y limitante del anticuerpo monoclonal, LIB-MC2. Las soluciones del analito-anticuerpo fueron incubadas por una hora a temperatura ambiente y después inyectadas sobre la superficie del sensor. La frecuencia de resonancia del cristal piezoeléctrico se registró en tiempo real mientras ocurría el enlace entre el anticuerpo libre y el conjugado inmovilizado. Terminado cada ensayo, la regeneración de la superficie del biosensor se logró usando HCl diluido 0.1 M para romper la asociación anticuerpo-conjugado de ensayo inmovilizado. Las curvas patrón representativas del ensayo se obtuvieron como promedio de varias curvas patrón individuales. Igual procedimiento se siguió en Ocampo, March y Montoya (2007).
3. RESULTADOS Y DISCUSIÓN
Se emplearon monocapas autoensambladas (SAM) para asegurar la regeneración y reutilización de la superficie del sensor. La formación de SAM evita la desnaturalización potencial de la molécula inmovilizada proporcionando estructuras bien ordenadas unidas mediante enlace covalente.
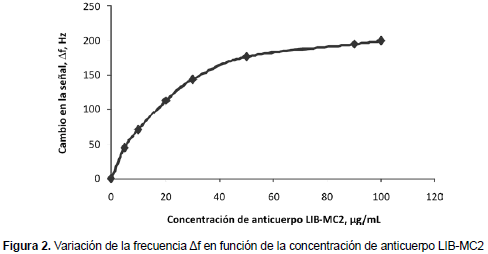
Para averiguar la concentración óptima de anticuerpo monoclonal LIB-MC2 en el ensayo competitivo con el inmunosensor piezoeléctrico, se analizaron diferentes concentraciones y se observó su correspondiente variación de frecuencia (Δf) en Hz. La figura 2 muestra la curva dosis-respuesta obtenida. Como se observa en esa figura, en todas las curvas dosis-respuesta, cuanto mayor es la concentración de MAb, mayor es la Δf obtenida. Esta influencia en la respuesta parece que tiende a alcanzar su máximo a concentraciones de MAb de alrededor de 100 μg/mL. Con el fin de obtener una señal adecuada con el mínimo gasto de MAb posible, se estimó qué valores de Δf de 100 Hz eran adecuadas para trabajar. Además por ELISA se conoce que en los inmunoensayos competitivos cuanto más baja es la concentración de anticuerpo involucrado en la interacción, más posibilidades existen de detectar concentraciones bajas de plaguicida. Así pues se seleccionó como concentración de trabajo 20 μg/mL, que es la concentración de anticuerpo LIB-MC2 con la cual se obtienen Δf ≈ 100 Hz.
Las figura 3 muestra las curvas patrón obtenidas en el análisis de TCP usando cristales inmovilizados mediante SAM simples (azul) y MSAM (rojo). Como se puede observar, las dos curvas son sigmoideas típicas de los ensayos competitivos, en los que concentraciones crecientes de analito (TCP) producen señales decrecientes. La curva correspondiente a la MSAM está ligeramente desplazada hacia la izquierda respecto a la correspondiente a la SAM. Esto significa que con los cristales inmovilizados por medio de MSAM se obtuvieron sensibilidades un poco mayores que con los inmovilizados mediante monocapas simples. En efecto, el límite de detección (I90) fue de 9,5 μg/L con MSAM, mientras que con SAM fue de 16 μg/L, y en cuanto a la sensibilidad (definida como I50) y el rango de trabajo (definido como I80-20), los valores obtenidos con MSAM fueron 39 y 18-74 μg/L respectivamente; para SAM estos valores fueron de 52 y 25-100 μg/L respectivamente. Así pues se observa que con el empleo de MSAM se obtienen valores más bajos que con SAM, lo que se traduce en una mejora tanto en sensibilidad como en límite de detección y rango de trabajo, siendo estos últimos valores del orden de la mitad que con SAM.
March et al. (2009) llevaron a cabo ensayos con monocapas simples y reportaron valores inferiores a los anteriores. Consideramos que esto es debido a algún grado de deterioro de los reactivos, puesto a que no se dispone en el laboratorio de inmunosensores de la EIA de condiciones rigurosas de temperatura para su conservación en el almacenamiento y transporte. Sin embargo los resultados son comparables en orden de magnitud.
Cada uno de los 10 puntos que aparecen en las curvas de la figura 3 se obtuvo mediante el promedio de cuatro lecturas realizadas por duplicado, por lo que cada punto corresponde al promedio de 8 valores. En todas las lecturas se observó que la lectura de la resistencia era casi constante y, por lo tanto, el decrecimiento en la frecuencia se debe exclusivamente a la masa de anticuerpo depositada sobre la superficie del cristal. Lo anterior hizo posible la generación de las curvas de calibración estándar que se presentan. Estas curvas tienen la forma típica de decrecimiento sigmoidal que se ajustaron a la ecuación logística de cuatro variables presentada en la sección 2.4, donde el valor máximo ocurrió cuando la concentración del analito (TCP) fue cero.
Una de las ventajas que mostró este inmunosensor fue su reusabilidad. Después de 100 ensayos de regeneración con HCl 0,1M, el inmunosensor, aunque presentó una disminución de cerca del 40% en la detección de la señal máxima, no hubo un cambio significativo en la sensibilidad, medida por el valor I50. Esto confirma la estabilidad y reusabilidad de este inmunosensor recubierto con el conjugado.
4. CONCLUSIONES
La reproducibilidad de los resultados obtenidos confirma la validez del método para el desarrollo de un inmunosensor piezoeléctrico llevado a cabo en otra etapa de esta investigación para la detección de plaguicidas.
Se ha estandarizado un sistema de inmovilización del conjugado de hapteno usando monocapas autoensambladas de dos tipos: simples y mixtas.
Se apreciaron ventajas en cuanto a los valores de límite de detección y rango de trabajo obtenidos empleando monocapas mixtas en relación con las simples. En efecto, el límite de detección fue de 9,5 μg/L para las MSAM frente a los 16 μg/L obte- nidos con las monocapas simples; mientras que los valores correspondientes al rango de trabajo oscilaron entre 18 y 74 μg/L con las MSAM, y entre 25 y 100 μg/L con las SAM simples.
Lo anterior indica claramente que el inmunosensor desarrollado, empleando MSAM, permite determinar TCP a concentraciones aproximadamente 1,5 veces menores que con las monocapas simples. La sensibilidad alcanzada permite, por otro lado, analizar este metabolito de acuerdo con la normativa europea para frutas y verduras.
AGRADECIMIENTOS
A Colciencias-SENA por la cofinanciación del proyecto "Desarrollo de inmunosensores piezoeléctricos y de su aplicación en la determinación de plaguicidas". Al proyecto PETRA II del programa europeo Alfa, a la Universidad Politécnica de Valencia (UPV) y a la Escuela de Ingeniería de Antioquia (EIA). A los pares evaluadores cuyos valiosos aportes mejoraron de manera sustancial la presentación de este trabajo.
REFERENCIAS
Agency for Toxic Substances & Disease Registry (ATSDR) (n.d.). Division of Toxicology and Environmental Medicine. (Consulted on April 8, 2011) Available in (www.atsdr.cdc.gov/es) [ Links ]
Arnau, Antonio; Jiménez, Yolanda and Sogorb, Tomás (2000). "Thickness-shear mode quartz crystal resonators in viscoelastic fluid media". Journal Applied Physics, vol. 88, No. 8 (July), pp. 4498-4506. [ Links ]
Banks, K. E. and Hernández, S. (2003). "Evaluation and validation of commercially available enzyme-linked immunosorbent assays (ELISAs) specific for atrazine, chlorpyrifos, and diazinon in aquous phase". Talanta, vol. 61, No. 3 (November), pp. 257-265. [ Links ]
Briand, Elisabeth; Salmain, Michèle; Herry, Jean-Marie; Perrot, Hubert; Compère, Chantal and Pradier, Claire-Marie (2006). "Building of an immunosensor: How can the composition and structure of the thiol attachment layer affect the immunosensor efficiency?". Biosensors and Bioelectronics, vol. 22, No. 3 (September), pp. 440-448. [ Links ]
Disley, Darren M.; Cullen, David C.; You, Hong-Xing and Lowe, Christopher R. (1998). "Covalent coupling of immunoglobulin G to self-assembled monolayers as method for immobilizing the interfacial-recognition layer of a surface plasmon resonance immunosensor". Biosensors and Bioelectronics, vol. 13, No. 11 (November), pp. 1213-1225. [ Links ]
Duan, Chuanming and Meyerhoff, Mark E. (1995). "Immobilization of proteins on gold coated porous membranes via an activated self-assembled monolayer of thioctic acid". Mikrochimica Acta, vol. 117, No. 3-4 (March), pp. 195-206. [ Links ]
European Parliament. (2001). Decision No. 2455/2001/EC of the European Parliament and of the Council of 20 November 2001, establishing the list of priority substances in the field of water policy and amending Directive 2000/60/EC. Amsterdam: Official Journal European Community. L331, 15/12/2001, pp. 1-5. [ Links ]
FAO/WHO. Pesticide residues in food: 1982. Evaluations. Data and recommendations of the Joint Meeting on Pesticide Residues, Rome (23 November - 2 December, 1982). FAO Plant Production and Protection Paper No. 49. Rome: FAO, 1983. [ Links ]
Ferretti, Silvia; Paynter, Sally; Russell, David A.; Sapsford, Kim E. and Richardson, David J. (2000). "Self-assembled monolayers: A versatile tool for the formulation of bio-surfaces". Trends in Analytical Chemistry, vol. 19, No. 9 (September), pp. 530-540. [ Links ]
García-Raya, Daniel (2009). Monocapas autoensambladas (SAMs) y nanopartículas metálicas (MPCs) como elementos en la arquitectura de interfases funcionales. Tesis Doctoral, Departamento de Química Física y Termodinámica Aplicada, Universidad de Córdoba, España. [ Links ]
Grabarek, Zenon and Gergely, John (1990). "Zero-length crosslinking procedure with the use of active esters". Analytical Biochemistry, vol. 185, No. 1 (February), pp. 131-135. [ Links ]
Hiemstra, M. and De Kok, A. (1994). "Determination of N-methylcarbamate pesticides in environmental water samples using automated on-line trace enrichment with exchangeable cartridges and high-performance liquid chromatography". Journal Chromatography A, vol. 667, No. 2 (April), pp. 155-166. [ Links ]
Jiang, Xuesong; Li, Dongyang; Xu, Xia; Ying, Yibin; Li, Yanbin; Ye, Zunzhong and Wang, Jianping (2008). "Immunosensors for detection of pesticide residues". Biosensors and Bioelectronics, vol. 23, No. 11 (January), pp. 1577-1587. [ Links ]
Kanazawa, Keiji and Gordon, Joseph G. (1985). "The oscillation frequency of a quartz resonator in contact with liquid". Analytica Chimica Acta, vol. 175 (June), pp. 99-105. [ Links ]
Manclús, Juan and Montoya, Angel (1995). "Development of immunoassays for the analysis of chlorpyrifos and its major metabolite 3,5,6-trichloro-2-pyridinol in the aquatic environment". Analytica Chimica Acta, vol. 311, No. 3 (August), pp. 341-348. [ Links ]
Manclús, Juan and Montoya, Angel (1996). "Development of an enzyme-linked immunosorbent assay for 3,5,6-trichloro-2-pyridinol. 1. Production and characterization of monoclonal antibodies". Journal of Agricultural and Food Chemistry, vol. 44, No. 11 (November), pp. 3703-3709. [ Links ]
March, Carmen; Manclús, Juan; Jiménez, Yolanda; Arnau, Antonio and Montoya, Ángel (2009). "A piezoelectric immunosensor for the determination of pesticide residues and metabolites in fruit juices". Talanta, vol. 78, No. 3 (May), pp. 827-833. [ Links ]
Mauriz, E.; Calle, A.; Abad, A.; Montoya, A.; Hildebrandt, A.; Barceló, D. and Lechuga, L. M. (2006a)."Determination of carbaryl in natural water samples by a surface plasmon resonance flow-through immunosensor". Biosensors and Bioelectronics, vol. 21, No. 11 (May), pp. 2129-2136. [ Links ]
Mauriz, E.; Calle, A.; Lechuga, L. M.; Quintana, J.; Montoya, A. and Manclús, J. J. (2006b). "Real-time detection of chlorpyrifos at part per trillion levels in ground, surface and drinking water samples by a portable surface plasmon resonance immunosensor". Analytica Chimica Acta, vol. 561, No. 1-2 (March), pp. 40-47. [ Links ]
Montoya, Angel; Ocampo, Aquiles and March, Carmen. Fundamentals of piezoelectric immunosensors. In: A. E. Arnau. Piezoelectric transducer and aplications, 2nd ed. (pp. 289-306). Valencia: Springer, 2008. [ Links ]
Ocampo, Aquiles; March, Carmen y Montoya, Angel (2007). Inmunosensores piezoeléctricos: Revisión general y su aplicación en el análisis de pesticidas. Revista EIA, No. 7 (junio), pp. 97-110. [ Links ]
Sanz, J.; Sáenz, C.; Galarreta, M. T. and Galbán, J. (1991). "Study of the decay of diazinon and chlorpyrifos in apple samples, using gas chromatography". Food Chemistry, vol. 42, No. 2, pp. 213-224. [ Links ]
Sauerbrey, Günter (1959). "Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung". Zeitschrift für Physik, vol. 155, No. 2 (April), pp. 206-222. [ Links ]
Susmel, S.; Guilbault, G. and O'Sullivan, C. (2003). "Demonstration of labeless detection of food pathogens using electrochemical redox probe and screen printed gold electrodes". Biosensors and Bioelectronics, vol. 18, No. 7 (July), pp. 881-889. [ Links ]