Introducción
El conocimiento de la biodiversidad, es un tema importante y complejo que abarca desde la variabilidad genética de especies, hasta el conocimiento de las relaciones que se establecen entre los seres humanos y la naturaleza 1. Por la riqueza en recursos naturales de Colombia se debe apoyar la investigación de los mismos, como una herramienta en la búsqueda de nuevos principios activos que aporte al crecimiento económico y desarrollo social del país.
El 40 % de las investigaciones en biodiversidad centran su trabajo en las plantas como grupo taxonómico, 33 % en vertebrados, 21 % en invertebrados y sólo el 14 % en los microorganismos. El conocimiento sobre metabolitos generados por especies nativas es escaso en la actualidad, por eso el particular interés se centra en entender este proceso para la cepa nativa SPG 321 de Mucor circinelloides. La cepa fue recolectada en el páramo de Guasca 2; este es un hongo filamentoso que pertenece a la clase Zygomycetes, al cual se le realizó aislamiento de metabolitos mayoritarios y se evaluó su actividad antimicrobiana y antifúngica.
Materiales y métodos
Microorganismo
Se seleccionó la cepa de Mucor circinelloides SPG 321, de la colección de especies del banco de cepas del grupo de investigación de Biotransformación de la Universidad Javeriana GIBUJ, conservada en suelo. Para su activación, se esparcieron granos de suelo sobre agar papa dextrosa (PDA), Agar Czapeck (Cz) y agar extracto de malta (MEA). Se obtuvieron cultivos monospóricos para su identificación.
Identificación
Teniendo en cuenta las claves taxonómicas de Gilman 3 y Samson y otros autores 4, se realizó la observación macroscópica durante la primera y la segunda semana. Se realizó la identificación microscópica utilizando azul de lactofenol, en diferentes aumentos, se estudió el crecimiento de la cepa en luz azul y se realizó prueba de termotolerancia 5.
Parámetros cinéticos
A partir de una suspensión de 1x107 conidias/mL, en caldo papa-glucosa-sulfato de amonio (PGS), a pH 7.0 ± 0.2 y 5 ml se utilizaron 16 erlenmeyer de 250 ml por un periodo de 384 horas, con relación 1/5 de aireación. Se identifican las fases de crecimiento 6.
Proceso fermentativo
La fermentación en batch se llevó a cabo en erlenmeyer de 5 litros, con un volumen efectivo de trabajo (VET) de 1000 mL. En medio PGS, se alcanzó 20 litros de caldo de cultivo. Cada fermentación se lleva a cabo a temperatura ambiente por 11 días (264 horas) con agitación de 160 rpm. Para la aireación se usó motor ELITE 799 con una salida de aire de 1000cc/min, conservando la proporción de 1/5 para proporcionar un medio aeróbico al cultivo 7,8.
Extracción de los metabolitos
Los cultivos de cada fermentación se filtraron al vacío, de esta manera se obtuvo caldo y biomasa. Para el caso del caldo se realizó una extracción líquido-líquido con AcOEt, se concentró al vacío en rota vapor BUCHI-RE111 y se obtuvo un extracto crudo de caldo. La biomasa seca se maceró y percoló con diferentes solventes en técnica Soxhlet 9. Los extractos totales se fraccionaron con diferentes solventes, las fracciones de interés se purificaron mediante cromatografía de capa fina y cromatografía de columna en sílica gel.
Evaluación de la actividad antimicrobiana
Se determinó la actividad antibacterial del extracto crudo de caldo y de la biomasa a una concentración de 2mg/(L y las fracciones respectivas a 1mg/(L. Se utilizó el ensayo de difusión en gel, con cultivos de 18-24 horas en caldo nutritivo (pH 6.5+/- 0.2 a 25 °C) con los microorganismos Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 y Bacillus subtilis ATCC, utilizando el método de difusión en agar 10,11.
A los compuestos que resultaron positivos por el método anterior, se les realizó bioautografías, sembrando una placa cromatográfica de 7 cm de largo x 2.5 cm de ancho.
Para evaluar la actividad antifúngica se utilizó el método de difusión en pozo 12. Como microorganismo indicador se seleccionó Fusarium oxysporum, por ser de crecimiento rápido y no poseer ciclo sexual definido 10.
Resultados y discusión
Identificación
En relación con las características microscópicas de las colonias obtenidas del cultivo de la cepa SPG 321, se observó la presencia de columella elipsoidal, de color café-grisáceo, presencia de hifas cenocíticas con esporangiosporas de pared lisa, elipsoidales de forma alargada y color café (ver figura 1 a y b).
Frente a la dificultad para la identificación de las más de 50 especies válidas para el género Mucor se evaluó el crecimiento en luz azul como se encontró en el estudio de Fátima Silva y Garre 13 y se observó crecimiento a 37º C según literatura 5.
Estos datos permiten realizar la clasificación de la cepa SPG321. Como perteneciente al género Mucor y la presencia de pigmentos naranjas bajo condiciones de luz azul confirman la especie circinelloides13.
Preinóculo
Se manejó un volumen efectivo de trabajo (VET) de 25 ml, preparados a partir de 24.5 ml de medio papa-dextrosa-sulfato de amonio (PGS), al que se le agregaron 0,25ml de una suspensión de conidios a una concentración de 1x 107 conidios/ml. Se incubó a 25º C y con agitación a 180 rpm; por 3 días conservando la proporción de 1/5 en Erlenmeyer de 125 ml 7,8.
Cinética de crecimiento de Mucor circinelloides
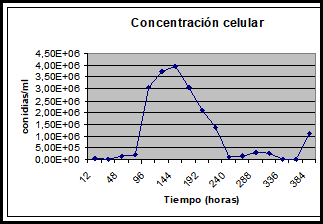
Para determinar el comportamiento de la cepa nativa SPG 321 en relación con la cinética del microorganismo y su relación con la producción de metabolitos secundarios, se procede al análisis de los parámetros que influyen en el diseño de los procesos de fermentación.
La concentración de la biomasa cambió progresivamente en el tiempo, aunque presentó una declinación en la hora 240. Debido a que los nutrientes de primera mano empiezan a agotarse 13 de tal forma que la velocidad de crecimiento declina; la biomasa, alcanzó su máximo peso en la hora 384, debido a la acumulación de productos de almacenamiento como lípidos, polisacáridos y la síntesis de metabolitos secundarios (ver figura 3).
Consumo de sustrato
Al analizar el consumo de sustrato para la cepa nativa SPG 321 de Mucor circinelloides se obtiene la gráfica 4. Se observa una disminución de glucosa en el tiempo, debido a que es usada como fuente de carbono, es decir, disminuye al ser usado como sustrato en la síntesis de nuevo material celular.
Entre las horas 144 y 192 se observa un descenso, con un aumento en la hora 216, lo que se asocia como una diauxia. Si se tiene en cuenta que el medio PGS contiene dos fuentes de carbono diferentes dextrosa y almidón. Mucor circinelloides utiliza aquella fuente que le proporciona mayor rendimiento energético en este caso la glucosa. Cuando ésta se acaba hay un tiempo de adaptación hacia el segundo substrato que a continuación es consumido, en este caso el almidón.
El rendimiento y velocidad de crecimiento es mayor para el primer substrato que para el segundo.
La cepa nativa, de Mucor circinelloides SPG 321 presentó una curva típica de desarrollo; al inocularse en el medio líquido PGS, la tropofase de acuerdo con la concentración celular se inició a las 72 horas, por división celular y formación de nuevo protoplasma a partir de los componentes del medio PGS. La declinación se presentó a partir de la hora 168 debido a que los nutrientes sufren pérdida en la concentración.
La fase conocida como idiofase, se presentó a partir de las 168, horas, para Mucor circinelloides SPG 321, y culminó a las 264 horas día 11.
La fase de latencia, para la cepa nativa SPG 321 de Mucor circinelloides termina a las 48 horas e inicia la tropofase, una vez se adapta a las condiciones de crecimiento, proporcionadas, por el medio PGS. El crecimiento de la biomasa es descrito cuantitativamente por unidad de tiempo en una gráfica semilogarítmica y culmina a las 168 horas como lo muestra la figura 5.
Fases de crecimiento cepa nativa SPG 321 Mucur circinelloides
En relación con la cinética, se encontró que la cepa nativa presentó una curva típica de desarrollo al inocularse en el medio líquido PGS, (figura 7) la tropofase inició a las 72 horas y culminó a la hora 168, la idiofase finalizó en la hora 264 día 11 y se tomó éste como día clave para la finalización de la fermentación.
Determinación de parámetros cinéticos
Los parámetros, a determinar en este estudio fueron, μx velocidad específica de crecimiento (h-1), Y x/s rendimiento de biomasa a partir de sustrato (g/g), td tiempo de duplicación (h) y productividad (gL-1/h). Para determinar los parámetros cinéticos en la fermentación llevada a cabo en un biorreactor de1, 5L, se aplicó la cinética de orden 1 con un R2 = 0,9579

Fuente: elaboración propia
Figura 8 Velocidad especifica de crecimiento de Mucor circinelloides en Biorreactor
Analizando el dato obtenido se concluye que la velocidad máxima de crecimiento es baja, debido a las condiciones de fermentación, ya que la cepa de Mucor circinelloides necesita energía adicional para degradar substratos de cadena larga, como es el almidón de papa, presente en el medio.
Comparado con lo reportado por la literatura; para Mucor hiemales, que tiene una μmax de 0,17, en comparación con 0,0086 mg/h-1 este valor confirma que Mucor, estaba en condiciones de estrés, lo cual se deduce, teniendo en cuenta que, en la tropofase, la prioridad es el aumento de biomasa, cuando los microorganismos se cultivan en un medio rico, balanceado de nutrientes.
Los metabolitos secundarios tienden a ser biosintetizados después de que la tasa de crecimiento ha cesado. Se desconoce la función del metabolito secundario, pero la bioactividad de estos compuestos ha sido explotada entre otras aplicaciones industriales como medicamentos, venenos, agentes saborizantes 14.
Compuestos químicos aislados
Del extracto de caldo fracción AcOEt se obtuvieron dos fracciones CH2Cl2 y PETROL. La biomasa se trabajó en dos fracciones CHCl3 y PETROL y se aisló un cristal en forma de agujas denominado M.c B3, al que se le realizó análisis de RMN1 H y CG-EM. Por las características del espectro este compuesto se asemeja a un esterol, se reporta la presencia de los ácidos grasos: palmítico, palmitoléico, esteárico y oleico, resultados dados por la técnica de gases acoplado a masas CG-EM, que confirman la importancia de Mucor circinelloides y su potencial como hongo oleaginosos, reportado por su uso comercial en la producción de aceite rico en ácidos grasos insaturados 15,16.
Evaluación antimicrobiana
Se determinó la actividad antibacterial de la fracción PETROL y CHCl3 Los datos encontrados para estas dos fracciones se consignan en la tabla 2. Se consideraron indeterminados los halos con diámetro de 13-14 mm y resistentes los menores o iguales a 12 mm 17-19. La fracción CHCl3 no mostró actividad inhibitoria para los microorganismos grampositivos Staphylococcus aureus ATCC 25923 y Bacillus subtillis (ATCC 25921), indeterminado para Eschericha coli (ATCC 25922).
Tabla 2 Actividad antibacteriana en las fracciones PETROL y CHCl3 de biomasa

Fuente: elaboración propia

Fuente: elaboración propia
Figura 9 Pruebas antibacterianas A. S. aureus B. B. subtilis y C. E. coli
Los resultados permiten concluir que la fracción CHCl3 presentó actividad inhibitoria contra Staphylococcus aureus ATCC 25923 activa y contra Bacillus subtilis (ATCC 25921), aunque se trata de fracciones orgánicas cuya composición se desconoce. La fracción CHCl3 que dio positiva por el método anterior, se le realizó contraplacas por la técnica de la bioautografías con zona de inhibición.
Se midieron los frentes de las bandas observadas de cada cromatograma y se determinó un Rf para la fracción CHCl3 (20-21), en medio con suspensión de S. aureus correspondiente a la región de macrólidos. Los extractos totales de caldo de cultivo, biomasa y sus correspondientes fracciones y compuesto M.c B3 de la fermentación, probados frente a Fusarium oxysporum no presentaron actividad alguna.
Conclusión
Los resultados obtenidos muestran, que la fracción CHCl3 en biomasa presenta actividad inhibitoria para los microorganismos grampositivos Staphylococcus aureus ATCC 25923 y Bacillus subtilis (ATCC 25921), lo que sugiere una fuente de productos con potencial biotecnológico y colocan a la cepa nativa SPG 321 de Mucur circinelloides como un microorganismo promisorio