Introducción
La actividad acuícola en la actualidad es uno de los renglones pecuarios que más crecimiento ha tenido durante los últimos decenios en el mundo, muchos factores han influido sobre este desarrollo, entre ellos la disminución de la pesca de captura por la sobreexplotación, la contaminación e, incluso, el cambio climático global. Es así como el informe del Estado mundial de la pesca y la acuicultura del 2016 (FAO, 2016, 22), indica un crecimiento promedio anual del 8,8% desde 1980; producción que se destina casi en su totalidad para el consumo humano. Ahora bien, el mercado mundial acuícola es sostenido por 362 peces de escama (con inclusión de híbridos), 104 moluscos, 62 crustáceos, 6 ranas y reptiles, 9 invertebrados acuáticos y 37 plantas acuáticas (FAO 2016, 25). En Colombia se producen, principalmente, cíclidos (Oreochromis niloticus y O. sp), un salmónido (Oncorhynchus mykiss), un carácido (Piaractus brachypomus) y un crustáceo (Litopenaeus vannamei) (Merino, Bonilla y Bages 2013, 52). Esta baja diversificación de los productos de origen acuícola se debe, principalmente, al desconocimiento de las técnicas de adaptación al cautiverio, manejo reproductivo, larvicultura, levante y engorde de peces nativos. Aunque existen algunos trabajos importantes, la mayoría de estudios sobre algunas de estas especies con potencial se han limitado solo a la fase de reproducción, sin abordar ni profundizar sobre las condiciones que requieren las larvas para su desarrollo y producción en masa.
Se sabe que, en especies que exhiben comportamiento agresivo y canibalismo, es importante implementar diferentes tipos de estrategias, de las cuales se conoce muy poco o no existe estandarización. La falta de información del efecto de las dietas sobre el desarrollo larval, de los protocolos de alimentación, de las técnicas de acostumbramiento a dietas comerciales, del momento adecuado para el cambio de alimento vivo a alimento inerte, del tipo de contenedor, de la calidad del agua, no han permitido una verdadera industrialización del proceso de larvicultura, alevinaje y cultivo de estas especies.
Con este panorama, y teniendo en cuenta que la pesca de captura está llegando a sus límites máximos permitidos (75%), la producción acuícola necesitará crecer cinco veces más en las próximas cinco décadas en vista del incremento en la población, por tanto, en el consumo per cápita (que pasará de 17 kg en el 2008 a 40 kg en el 2050) y el aumento de la demanda por el consumo de productos saludables (Wijkström, 2003, 466). Por estas razones es de importancia conocer a fondo todos los procesos que rodean el desarrollo larval que se convierten en la base para el desarrollo de los emprendimientos en acuicultura.
Estado larval
Entender el estado larval y clasificarlo ha sido una constante discusión, en vista de la cantidad de cambios morfofisiológicos y de adaptaciones que ocurren en un corto período de tiempo. Para Balfour (1880), citado en Hall y Wake (1999, 5), la larva es un animal que nace en condiciones diferentes a las del adulto y puede considerarse como el elemento que dispersa la progenie, al igual que una semilla en los vegetales (Hall y Wake, 1999, 4). Otro estudio indica que la larva es un estado intermedio entre la eclosión hasta el desarrollo de un juvenil (Webb, 1999, 111). Se considera que el desarrollo larval es una combinación de cambios cualitativos en forma y función y que el umbral de estos cambios puede ser modificado por la aparición de estructuras y funciones en la ontogenia temprana. Esta capacidad de adaptarse al medio, a su vez se relaciona con las estrategias R y K, que definen una primera clasificación: larva altricial y larva precocial respectivamente (Balon, 1981, 585). El mismo autor indica que existen dos tipos de ontogenia: indirecta y directa, que están relacionadas con la disponibilidad de nutrientes del medio y con la alimentación que se da durante el ciclo de vida temprano. Por lo tanto, identificar los factores que promueven la plasticidad fenotípica es crítico para entender cómo estos organismos se adaptan a su medio (Kingsolver & Huey, 1998, 547).
Tanto en la pesquería como en la acuicultura, el medioambiente que los peces experimentan desde su temprano desarrollo ha determinado cambios en su tamaño, tasa de crecimiento, metabolismo, reproducción, entre otros (Pittman et al., 2013, S224); probablemente por esa presión, diferentes tipos de alimentación en el desarrollo larval se presentan como respuesta a dichos cambios, estos son: la alimentación endógena, exógena, de absorción y una combinación de las tres (Balon, 1986, 11). Además de considerar la importancia que tiene el estado nutricional de la hembra, el cual determina la composición química del vitelo que servirá de alimento endógeno en el proceso de desarrollo larval (Dabrowski, 1984, 808).
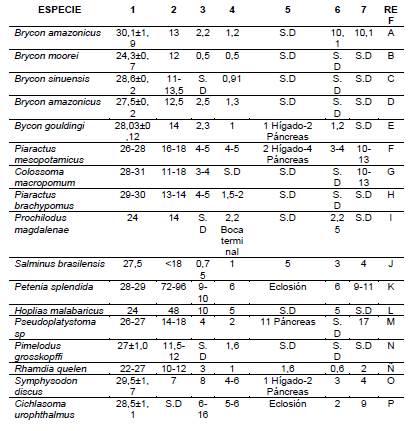
En el desarrollo larval es importante reconocer las etapas clave que permiten asociar la toma de decisiones sobre protocolos de alimentación o cuidados para obtener mayores porcentajes de sobrevivencia. Datos de tiempo de eclosión asociados a la temperatura, a la absorción del saco de vitelo, al inicio de la primera alimentación, a la diferenciación del tracto gastrointestinal, a la diferenciación de órganos acompañantes y a la presencia de glándulas gástricas, son determinantes en la larvicultura de cualquier especie, como puede ser observado en la tabla 1.
1: TEMP. °C -2: ECLOSIÓN -Horas posfertilización (HPF) - 3: ABSORCIÓN VITELO -Días poseclosión (DPE) - 4: INICIO EXOTROFIA - DPE -5: DIFERENCIACIÓN DE ÓRGANOS ANEXOS - DPE - 6: DIFERENCIACIÓN DE TRACTO DIGESTIVO - DPE - 7: PRESENCIA DE GLÁNDULAS GÁSTRICAS- DPE. FUENTE-(REF: Referencia): A: Newmann (2008, 15); B: David y Castañeda (2014, 182); C: Atencio, et al. (2010, 320); D: Arias-Castellanos (2006, 129); E: Faustino (2010, 58); F: Ribeiro et al., (1995, 69); G: Vieira & Johnston (1996, 845); H: Vásquez-Torres W. (2005, 213); David-Ruales et al., (2011, 49); I: Arias-Gallo, et al., (2010, 201); J: Mai (2009, 6); K: Treviño et al., (2011, 75); L: Gomes et al., (2007, 1421); M: Díaz-Olarte, et al., (2010, 1194); N: Valbuena-Villareal, et al., (2012, 155); Ñ: Silveira, et al., (2013, 1586), O: Clavijo-Ayala (2013, 130); P: Cuenca-Soria et al. (2013, 1306)
De la especie Brycon moorei (dorada del Magdalena), se conoce que es una especie omnívora oportunista o herbívora, en etapas juveniles con preferencia por insectos, y con predilección por semillas en etapas posteriores, con dependencia de alimentos alóctonos (frutos y semillas); por tal motivo la deforestación ha incidido drásticamente sobre las poblaciones silvestres, siendo catalogada como vulnerable a nivel nacional y en peligro crítico a nivel regional (Mojica et al., 2012, 99). La B. moorei en su etapa larval al inicio de la exotrofia, solamente consume organismos vivos de origen animal (zooplancton, larvas de insectos, ostrácodos, larvas de peces, anélidos, etc.), pero a medida que crece obtiene la capacidad de digerir alimentos vegetales, convirtiéndose desde la mitad de la fase larval en un organismo omnívoro (Olaya-Nieto et al., 2007, 121). El examen macroscópico del interior de las vísceras de los ejemplares adultos capturados permite establecer que poseen ciegos pilóricos y que se alimentan preferentemente de vegetales (guayabas, Psidium sp.; flores de arrayanes, Tabebuia chrysantha, frutos de palma, hojas de cámbulo, Erythrina poeppigiana, frutos de higuerón, Ficus luschnathiana y suribio, Zygialongifolia, etc.), aunque también devoran otros peces de las especies Astyanax sp., Aequidens pulcher, Hoplosternum magdalenae, Sorubim cuspicaudus, Pleuronectiformes, Cyphocharax magdalenae, etc.), además de reptiles, batracios, insectos y hasta pájaros o mamíferos pequeños que caigan al agua accidentalmente (Maldonado-Ocampo et al., 2005, 82; Olaya-Nieto et al., 2007, 121).
Ontogenia del tracto digestivo
Los peces teleósteos de agua dulce se caracterizan por tener larvas poco especializadas, con una gradual transición al estado juvenil (Webb, 1999, 112). Su canal alimentario es un tubo recto, cerrado en la boca, con características morfológicas, histológicas y fisiológicas menos elaboradas que el de los adultos, que permanece sin mayores cambios desde la apertura de la boca, hasta la absorción completa del saco de vitelo (Govoni et al., 1986, 60; Osman et al., 2008, 189). Luego de este proceso viene la segmentación en la cavidad bucofaríngea, en el intestino anterior, medio y posterior, se encuentra, así, que el período larval concluye con el desarrollo del estómago con glándulas gástricas y ciegos pilóricos; el hepatopáncreas se forma desde la eclosión y es funcional hasta la primera alimentación (Micale et al., 2008, 1079; Person, 1989, 626). Simultáneamente con el crecimiento y la complejidad del tracto digestivo, vienen marcadas diferencias en la dieta; muchas larvas pueden tener hábitos predadores planctófagos, independientemente de si el estado adulto es un filtrador (Govoni et al., 1986, 62).
En este mismo sentido, y dependiendo del desarrollo del tracto digestivo y de la secreción de enzimas en el intestino, las larvas se pueden clasificar en tres grupos: el primero con un estómago funcional como es el caso de los salmónidos; el segundo grupo sin estómago, pero con un intestino funcional diferenciado en tres segmentos y, por último, el gran grupo de los peces que no presentan estómago, ni glándulas gástricas funcionales, pero que tienen un desarrollo tardío de sus órganos digestivos (Dabrowski, 1984, 810).
Se puede asegurar que, en general, el origen del desarrollo de la morfología del tracto digestivo en peces (teleósteos de agua dulce) sigue los mismos patrones de organización y función que en mamíferos, indicando mecanismos celulares conservados (Wallace et al., 2005, 166). En la especie Danio rerio, utilizando hibridación "in situ de RNA" e inmunohistoquímica, se observó a las 21 horas posfertilización (HPF) los primeros signos de desarrollo del tracto digestivo en la gastrulación y, hasta la eclosión (48-72 HPF), ocurre la organización y polarización del epitelio columnar. A las 74 HPF, se alcanza la permeabilidad total del tracto digestivo, cuando el lumen de la faringe posterior es visible y la boca está abierta (Wallace & Pack, 2003, 15). Entre la eclosión y la apertura de la boca ocurre la formación de uniones epiteliales, las microvellosidades del borde de cepillo y la diferenciación de los principales tipos celulares, los enterocitos, las caliciformes y las enteroendocrinas; a las 102 HPF ocurre la apertura del ano (Ng et al., 2005, 122). El intestino es completamente funcional en el día 5 posfertilización cuando es visible un patrón de movimiento regular que marca la alimentación exógena (Holmberg et al., 2004, 4088). En P. mesopotamicus al cuarto día poseclosión (DPE) se presenta la absorción total del vitelo, pero indiferenciación del tracto digestivo; hacia el quinto DPE se inicia la alimentación exógena, se observa esófago y un estómago presuntivo e hígado, intestino indiferenciado con células con núcleo basal, células con borde de cepillo y sin existencias de pliegues intestinales; hacia el sexto DPE, se observan células mucosas en esófago y páncreas, el hígado con glucógeno e intestino con pliegues. Hacia el 12 día después de la primera alimentación (DPPA), se observa estómago con zona glandular y no glandular, además de ciegos pilóricos e intestino con células caliciformes y páncreas con zimógenos. Por último, hacia el 15 DPPA, se observa estómago diferenciado con una región pilórica sin glándulas gástricas y una región del cardias con glándulas gástricas (Mendes de Freitas T, 2015, 42).
Este tipo de desarrollo en el género Brycon puede ser más rápido, probablemente se deba a su hábito alimenticio (predador); es así como en larvas de la especie Brycon gouldingi, en la fase larval, se presentó el desarrollo de órganos adhesivos a la región cefálica, entre ellos corazón, pronefro, hígado y, principalmente, el sistema digestivo. La apertura bucal fue a las 9 HPE y la apertura del tubo digestivo fue a las 13 HPE; la aparición de los dientes se dio a las 21 HPE, se observa a las 37 HPE el consumo de larvas forrajeras. La absorción del vitelo se presentó entre las 54 a 55 HPE (Faustino et al., 2015, 104); para Brycon orbignyanus, el canibalismo inicia a las 36 HPE, como un claro indicio de estructuras digestivas desarrolladas para procesos digestivos exógenos (Reynalte-Tataje et al., 2004, 69).
En larvas de Brycon amazonicus, la cavidad bucofaríngea está abierta a las 24 HPE, el tubo digestivo se abrió en toda su extensión a las 25 HPE y dividiéndolo en cavidad bucofaríngea, esófago e intestino revestido ya por tejido epitelial cilíndrico. La alimentación exógena inició a las 29 HPE, indicando que la cavidad bucofaríngea y el esófago estaban revestidos por un epitelio estratificado pavimentoso. A las 35 HPE, surge un septo en la porción final del intestino, formando una bolsa en su porción proximal, acompañada al mismo tiempo de pliegues de la mucosa en el intestino medio. El inicio de la diferenciación del estómago ocurrió a las 83 HPE y terminó con las primeras glándulas estomacales en la región cardíaca a las 171 HPE. En este mismo tiempo, el esófago presentó pliegues longitudinales en la mucosa, con el epitelio revestido por células de moco. A las 243 HPE, se visualizaron innumerables ciegos pilóricos, en formación a la porción anterior del intestino y la forma en U del estómago estaba definida; en este momento todas las estructuras que componen el sistema digestivo estuvieron presentes (Neumann, 2008, 38).
En general, en larvas de peces, al inicio de la alimentación exógena, la longitud del intestino es un poco menor que la longitud total; el intestino medio está individualmente separado del anterior, el posterior por esfínteres musculares y, con pocas excepciones, el intestino se enrolla en un bucle antes del inicio de la primera alimentación. En la siguiente etapa de desarrollo, el tracto gastrointestinal incrementa su capacidad de absorción a través del alargamiento y del plegamiento de la mucosa, se engrosan las paredes por la maduración de los enterocitos, que incluye el desarrollo del borde de cepillo con largas microvellosidades (R0nnestad et al., 2013, S68); cuando se realiza un acostumbramiento temprano a dieta seca que no cumpla con los requerimientos y cuando la movilidad gastrointestinal, la digestión y la absorción no están completamente desarrolladas, generalmente resulta en desórdenes epiteliales, consecuentemente, con bajas tasas de crecimiento y sobrevivencia (Kamisaka et al., 2010, 43). También se reporta la reducción de la capacidad de proliferación del epitelio intestinal en larvas de Vimba vimba cuando la dieta se basó en aminoácidos libres y dipéptidos, al ser comparada con una dieta basada en alimento vivo y microdietas comerciales en coalimentación (Ostaszewska et al., 2008, 1271).
Alimentación exógena
El inicio de la alimentación exógena es la etapa crucial en el desarrollo larval de los peces y, dependiendo de su comprensión y manejo, se relaciona con grandes mortalidades en sistemas acuícolas (Yúfera & Darias, 2007, 54). En la medida en que las reservas endógenas son incapaces de mantener la demanda metabólica de la larva, esta debe empezar la alimentación exógena y comenzar una búsqueda activa para capturar e ingerir las presas, adquiriendo la capacidad de digestión y absorción de los nutrientes para su crecimiento y otras actividades como disipación de energía (R0nnestad et al., 1999, 206). Además puede presentarse un período de alimentación endo-exógena que en general prepara a la larva para la vida exotrófica. Es importante mencionar que, mediado por la temperatura (al menos para larvas marinas), en este período puede presentarse el punto de no retorno o momento asociado al ayuno irreversible, cuando el 50% de las larvas no puede iniciar su alimentación, incluso en presencia de alimento (Dou et al., 2002, 1373, 2005, 363).
Se conoce que en la primera alimentación el sistema digestivo no es completamente funcional, sin un estómago desarrollado, la digestión del alimento que se ingiere toma lugar en el intestino, donde el pH permanece alcalino y la actividad enzimática tipo tripsina, representa la actividad proteolítica (Kolkovski, 2001, 183). Las larvas de la mayoría de peces, al momento de iniciar su alimentación exógena, son organismos cuyo desarrollo todavía no se ha completado, razón por la cual los órganos digestivos no están totalmente definidos y el equipamiento enzimático es deficiente (Camacho et al., 2011, 696; Cestarolli et al., 1997, 14; Cestarolli, 2005, 120). Varios trabajos sobre primera alimentación evidencian el efecto de la dieta y corroboran lo descrito por Camacho et al., 2011; sin embargo, aunque resultados alentadores se han reportado usando en la primera alimentación dietas formuladas, la alimentación principal con organismos vivos como Artemia sp. y rotíferos, es aún aceptada por su calidad como la mejor estrategia disponible en la larvicultura de muchas especies (Aragão et al., 2004). En este sentido, cualidades como movimiento y color que estimulan su captura; mayor permanencia en la columna de agua (flotabilidad) y la no afectación de la calidad de la misma (Barrera et al., 2003) son, entre otras, características que favorecen su uso como primer alimento.
Otras características importantes del alimento vivo son sus propiedades atractantes, que actúan como estimulantes de la actividad alimenticia (Kolkovski et al., 1997) y su composición nutricional (Aragão et al., 2004, 430). En este sentido, se conoce que las larvas de peces poseen una gran proporción de aminoácidos libres (AaL) y que estos son una fuente importante de energía desde el desarrollo embrionario hasta la apertura de la boca (Portella et al., 2013, 427; R0nnestad et al., 1999, 205), a su vez, el alimento que la larva atrapa en el medio natural (zooplancton) presenta altos niveles de AaL (Helland et al., 2003, 224), de esta manera el contenido y la calidad de estas sustancias es probablemente esencial durante este período crítico cuando la larva cambia su dieta endógena a exógena (Kolkovski, 2008, 21). Por ejemplo, en larvas de Piaractus brachypomus de 36 HPE, se evidenció significativamente que los peces tratados con alimento vivo (Artemia sp y zooplancton silvestre) presentaron mejor desempeño que los tratados con alimento concentrado (David-Ruales et al., 2011, 51); en otro ensayo con larvas de Rhamdia sebae de 72 HPE, también se encontraron resultados similares con el uso de alimento vivo (David-Ruales et al., 2009, 9). De modo similar, larvas de Pimelodus grosskopfii alimentadas con nauplios de artemia presentaron los mejores resultados como primera alimentación (Valbuena et al., 2013, 3521) comparadas con cladóceros y copépodos. En este mismo sentido, larvas de Clarias gariepinus al inicio de la alimentación exógena presentaron resultados con diferencias significativas utilizando Artemia sp. en comparación con la dieta comercial (Segner y Verreth, 1995, 389). El trabajo de Sales (2011) hace un análisis de los trabajos reportados con el uso de alimento vivo vs. dieta seca y concluye que las larvas alimentadas con alimento inerte tienen 2,5 veces más probabilidad de morir que las que se alimentan con el alimento vivo (Sales, 2011, 1224). Coincidiendo con lo anterior, otro autor menciona que la utilización de alimento vivo es fundamental, en vista del aporte de enzimas exógenas, las cuales juegan un papel muy importante como iniciadores o activadores de la acción enzimática endógena (Person, 1989, 627).
Aunque haya evidencias de los beneficios del uso de alimento vivo como base para la primera alimentación de larvas, se ha demostrado que esta estrategia es costosa y a menudo no provee las características de estabilidad, seguridad y calidad nutricional requerida (Drossou et al., 2006, 480). Como respuesta a la inquietud que genera el uso específico de dieta viva por los costos de mantenimiento, se ha propuesto realizar protocolos de coalimentación que también incluyen larvas forrajeras y la formulación de microdietas con o sin enriquecimiento, en un periodo que se llama transición hasta el acostumbramiento a dieta seca. En larvas de grandes bagres el uso de alimento vivo (larvas forrajeras) en coalimentación con dietas secas también ha sido exitoso. Por ejemplo, en primera alimentación de Leiarius mamoratus (Ramírez-Merlano et al., 2010, 51), en larvas de Pseudoplatystoma sp. (Castañeda-Álvarez, 2009, 36; Castañeda-Álvarez, et al. 2014, 199; Marciales-Caro et al., 2011, 184), así como en larvas de Brycon moorei (David-Ruales & Castañeda-Álvarez, 2014, 184).
Por otro lado, el uso de dietas formuladas es una buena elección en la medida de su practicidad y costo. En protocolos de alimentación de larvas de Piaractus mesopotamicus, teniendo en cuenta la ontogenia del sistema digestivo, se encontraron excelentes resultados en el desarrollo larval usando dieta formulada en coalimentación con nauplios de artemia (Jomori et al., 2008, 374; 2005, 179; 2003, 281). Cuando se realiza acostumbramiento temprano a dieta seca, sin tener en cuenta el desarrollo del sistema digestivo, los resultados son variables, incluso suplementando la dieta con enzimas exógenas como en el caso de larvas de P. mesopotamicus (Tesser et al., 2006, 2213), o utilizando varios tipos de materias primas para elaborar las microdietas, para el caso de larvas de Stizostedion vitreum (Guthrie et al., 2000, 154). Probablemente esos resultados se deban a la baja palatabilidad, a la baja actividad enzimática y a la ausencia de actividad tipo pepsina (ausencia de estómago) en tempranas etapas del desarrollo larval (Kolkovski 2001, 184); aunque la hidrólisis proteica no es regulada únicamente por la pepsina, ya que también se lleva a cabo por enzimas pancreáticas e intestinales (Cahu & Zambonino Infante, 2001, 165), probablemente sea menos específica. Por lo tanto, para asegurar el tiempo exacto de la transición, se debe manejar un periodo de coalimentación, con enriquecimiento del alimento vivo (Kolkovski et al., 2000, 84), utilizando enzimas exógenas, con conocimiento e integración de las características de la ontogenia del tracto digestivo. En este sentido, es fundamental reconocer la presencia de glándulas gástricas (estómago funcional) que aseguren la actividad de la pepsina en la hidrólisis proteica. Así, utilizando varios protocolos de alimentación en larvas de Salminus brasiliensis, fue encontrado que existía, a partir del quinto día, la actividad de proteasa ácida y que por lo tanto desde ese momento sería factible el inicio de dieta seca (Vega-Orellana et al., 2006, 489). En otro reporte con larvas de Rhamdia quelen, donde se estudió el desarrollo morfológico del sistema digestivo y de la actividad de las enzimas proteolíticas, los autores concluyeron que esta especie es capaz de digerir dieta inerte al inicio de la alimentación exógena (Silveira et al., 2013, 1589).
Aspectos digestivos y enzimas
El conocimiento de la diferenciación histomorfológica de las glándulas del tracto digestivo y de los órganos accesorios, junto con los estudios funcionales sobre los procesos de digestión, absorción y transporte de nutrientes durante el desarrollo de las larvas, es esencial para la comprensión de la fisiología nutricional y digestiva de esta etapa de desarrollo. De esta manera, se cree que los tipos de digestión responsables del proceso digestivo son: la digestión que se da en los pliegues intestinales (digestión cavital) como mecanismo principal de la hidrólisis de biopolímeros y la digestión de membrana, que se encarga del estado intermedio y final de la hidrólisis de los nutrientes para promover su paso a los diferentes sistemas de transporte intracelular, sin embargo, en los estados tempranos de desarrollo larval (larva vitelínica), la digestión de membrana es el mecanismo predominante en la hidrólisis de nutrientes (Kuz'mina, 2008, 89). Se conoce que la ontogenia anatómica y funcional del tracto digestivo es similar en la mayoría de los teleósteos, teniendo en cuenta las diferencias que se dan entre larvas de tipo altricial, precosial, con estómago y sin esta cavidad; sin embargo existen importantes variaciones interespecíficas que se relacionan, principalmente, con el tiempo de aparición de algunos tejidos, de la actividad enzimática y probablemente la mayor diferencia sea el tiempo en el que el estómago se desarrolla. El momento en el que las glándulas gástricas aparecen y son funcionales puede variar entre algunas semanas o meses, dependiendo de la especie. Estas diferencias pueden ser adaptaciones en la evolución, principalmente por el tipo de dieta que se presenta en el medio natural (Rønnestad et al., 2013, S64). En condiciones de cultivo esta información es esencial para el establecimiento de prácticas apropiadas de alimentación y protocolos para sincronizar la cría de larvas (López-Vásquez et al., 2009, 1621).
La digestión de los principales nutrientes en larvas es un proceso poco conocido que se enfoca, básicamente, en el intestino medio y en el tercio posterior del tracto digestivo. El componente proteico es absorbido en las células epiteliales del intestino posterior, principalmente por pinocitosis por medio de las intramicrovellosidades de la membrana plasmática de los enterocitos, poco se conoce de la absorción de carbohidratos (Person, 1989, 626).
En general, las enzimas digestivas que hidrolizan proteínas, carbohidratos y lípidos, son secretadas dentro del lumen del canal alimentario, originadas de la mucosa gástrica, los ciegos pilóricos, el páncreas y la mucosa intestinal. Así, proteasas tipo pepsina, secretadas por la mucosa gástrica, presentan una óptima actividad a pH bajo, resultado de la secreción de HCl, de la misma mucosa (Western y Jennings, 1970, 882). Los ciegos pilóricos, que forman una extensión del intestino, secretan una variedad de enzimas tipo lipasa, carbohidrasas y proteinasas; esencialmente las mismas enzimas que en el intestino medio actúan en un pH neutral y/o ligeramente alcalino; el jugo pancreático es especialmente rico en tripsina (una proteasa con actividad óptima en pH ligeramente alcalino), además de amilasa, maltasa y lipasa (Portella & Dabrowsky, 2008, 252); el papel que juega cada uno de estos órganos en la producción total de enzimas digestivas varía considerablemente con la especie (Kapoor et al., 1976, 130).
Varios autores afirman que la acción enzimática es un proceso gradual en el que ciertas enzimas presentan su máxima actividad dependiendo del estado de desarrollo de la larva. En un estado más avanzado, en presencia del estómago funcional y por la acción de la pepsina, se facilita la hidrólisis completa de proteínas (péptidos y aminoácidos) y, en el intestino medio y posterior, enzimas pancreáticas e intestinales y otros complejos enzimáticos hacen que la digestión sea completa (Álvarez-González et al., 2005, 376; Gisbert et al., 2009, 384; Toledo-Solís et al., 2015, 271; Zacarías-Soto et al., 2013, 1334). Otros autores indican que, en las primeras etapas de desarrollo de larvas altriciales o precociales, las enzimas proteolíticas del páncreas son particularmente significantes, así la afinidad por uniones peptídicas involucra aminoácidos (aa) específicos, por ejemplo, lisina y arginina son catalizados por la tripsina y tirosina y fenilalanina por la quimotripsina; las cuales actúan en conjunto con exopeptidasas (carboxipeptidasas A y B), dando como resultado aa libres y pequeños péptidos que son hidrolisados por aminopeptidasas de los enterocitos, o por peptidasas intracelulares mediante transportadores peptídicos de membrana tipo PepT1 (Abolfathi et al., 2012, 168; Applebaum & Holt, 2003, 1162; Buentello et al., 2011, 207; Cara et al., 2007, 1801; Castañeda-Álvarez, 2009, 36; Darias et al., 2007, 374; Falcón-Hidalgo et al., 2011, 137; Galaviz et al., 2011, 164; Kuz'mina, 1996, 29; Kvåle et al., 2007, 461; Pérez-Casanova et al., 2006, 381; Silveira et al., 2013, 1584; Suzer et al., 2007, 472; Vega-Orellana et al., 2006, 488; Xiong et al., 2011, 58; Yúfera & Darias, 2007, 57); teniendo en cuenta que este tipo de enzimas son secretadas como proenzimas, las cuales son activadas en el lumen intestinal por enteroquinasas (Ogiwara & Takahashi, 2007, 7021).
La digestión lipídica en larvas y la identificación de enzimas lipolíticas específicas permanece poco estudiada. Varios autores reportan que la principal lipasa en teleósteos es la Lipasa Dependiente de Sales Biliares (BAL, por sus siglas en inglés), llamada también Hidrolasa-Carboxil-Ester; la cual actúa hidrolizando preferencialmente ácidos grasos poliinsaturados (Gjellesvik et al., 1992, 127; Olsen & Ring0, 1997, 10); ha sido identificada en Scophthalmus maximus (Hoehne-Reitan et al., 2001, 739); en Gadusmorhua (Sæle et al., 2010, 254); en Melanogrammus aeglefinus (Pérez-Casanova et al., 2006, 386) y en Pseudopleuronectes americanus (Murray et al., 2003, 819). La actividad de la Fosfolipasa 2a (PLA2), también se ha reportado en Moorone saxatilis (Ozkizilcik et al., 1996, 633); en Dicentrarchus labrax (Zambonino Infante & Cahu, 1999, 1197) y en la especie Hippoglossus hippoglossus (Evans et al., 1998, 372).
La principal carbohidrasa identificada en larvas de peces es la a-amilasa, que hidroliza uniones glucosídicas α1-4, del glucógeno y los almidones, para producir maltosa y oligosacáridos ramificados. Se han reportado estudios en la especie Dentex dentex (Gisbert et al., 2009, 384); en Seriola lalandi (Chen et al., 2006, 267); en Moorone saxatilis (Ozkizilcik et al., 1996, 634) y en larvas de Sciaenops ocellatus (Lazo et al., 2000, 186). La tabla 2 resume los trabajos sobre actividad enzimática en algunas especies de agua dulce.
Convenciones: 'juveniles- SD, sin dato - T, Tripsina; QT, Quimotripsina; A, Amilasa; L, Lipasa; LAP, Fosfolipasa Activada por Sales Biliares; P, Pepsina y FA, Fosafatasa Alcalina. Fuente: datos de las referencias.
Alta especificidad de las enzimas digestivas ha sido encontrada al inicio de la alimentación exógena, esto sugiere que el proceso de producción enzimático es iniciado por mecanismos genéticos subyacentes más que por factores inducidos, por ejemplo la dieta; sin embargo la composición y cantidad de la dieta puede influenciar la maduración del sistema digestivo, como un disparador del inicio o incremento de la actividad de algunas enzimas digestivas (Pérez-Casanova et al., 2006, 398). Probablemente el nivel de proteína en la dieta y el tamaño de las moléculas, con una adecuada cantidad de aa libres y pequeños péptidos (di y tripéptidos), se requieren como estímulo primario para activar la Colecistoquinina (CCK) y, por lo tanto, la liberación del tripsinógeno del páncreas y su posterior conversión a tripsina (Cahu et al., 2004, 301). Se ha demostrado que, dietas compuestas por proteínas nativas o aquellas que incluyen un porcentaje moderado de hidrolizados proteicos (alrededor del 14%), activan la secreción de tripsina y cuando los niveles de hidrolizados son superiores al 40% su actividad se reduce, lo que sugiere la existencia de mecanismos que controlan la liberación de CKK, sensitivos a la hidrólisis de la tripsina y mediado por la secreción pancreática en respuesta al consumo proteico (Cahu et al., 2004, 301).
Finalmente, es importante mencionar que aún existe controversia en torno a si enzimas exógenas que provienen de las presas vivas podrían directamente ayudar en la digestión de la larva, activar zimógenos o contribuir con algún tipo de hormonas digestivas. Los estudios parecen indicar que la cantidad de enzimas producidas por la mayoría de las larvas de peces son suficientes para digerir apropiadamente el alimento vivo y, probablemente, dietas artificiales y el grado de contribución de las enzimas exógenas no indican ser importantes, al menos cuantitativamente (Kurokawa et al., 1998, 498).
Conclusiones y perspectivas
Aunque numerosa información ha sido generada para algunas especies (modelo Danio rerio), todavía se conoce muy poco de los patrones de desarrollo ontogénico para larvas de especies nativas del neotrópico, así como también sobre la influencia de las dietas (microdietas), el posible uso de iniciadores (atractantes, hidrolizados, inmunoestimulantes) en la asimilación de nutrientes y sobrevivencia larval. Incluso muy poco se conoce sobre los requerimientos nutricionales en estados tempranos de desarrollo. De manera general, escasos datos se registran sobre la influencia de hormonas en el control endocrino y la regulación de la actividad digestiva en etapas tempranas, así mismo, muy poco se conoce sobre la asimilación de lípidos y las rutas metabólicas asociadas a esta asimilación, incluso el papel de los carbohidratos en el desarrollo larval es aún desconocido; muy poco se conoce de órganos sensoriales y su participación en la primera alimentación. Nada se conoce de la influencia de la microbiota acompañante en estados tempranos de desarrollo, que puede tener una gran influencia en la expresión enzimática de larvas altriciales. Para bien, en la actualidad existen muchas técnicas biotecnológicas que podrían servir de herramienta para realizar análisis que permitan incrementar el conocimiento sobre la etapa larval.
Se espera entonces que los interesados en el desarrollo de la acuicultura revisen la información que se produce y la apliquen para ampliar el conocimiento y manejo de las especies neotropicales, no solo con fines comerciales en acuicultura, también con fines ecológicos tendientes a preservar estas especies.