Introducción
La leishmaniasis es una enfermedad tropical de transmisión vectorial (ETV) causada por la infección con cualquiera de las 20 especies de parásitos protozoarios diferentes pertenecientes al género Leishmania, con la cual se pueden ver afectadas la piel (leishmaniasis cutánea o LC), las mucosas (leishmaniasis mucocutánea o LMC) o las vísceras (leishmaniasis visceral o LV) (Herwaldt, 1999; Ul Bari, 2006). En el continente americano es transmitida al humano a través de la picadura de insectos hembras hematófagas infectadas del género Lutzomyia. Colombia es el segundo país después de Brasil con el mayor número de casos de LC en el continente. En el año 2017 se reportaron en Colombia un total de 7764 casos, y se estimó que el 56 % de la población estaba en riesgo de contraer la forma cutánea de la enfermedad (World Health Organization [WHO], 2019; Organización Panamericana de la Salud [PAHO], 2019). La leishmaniasis cutánea es actualmente la enfermedad parasitaria que más afecta el pie de fuerza en el Ejército Nacional de Colombia, y es preciso señalar que entre los años 2008-2018 se reportaron 40 185 casos, seguido de 559 casos de leishmaniasis mucocutánea en el personal militar activo, según reporte del Sistema Nacional de Vigilancia en Salud Pública (Sivigila) y Salud Operacional de la Dirección de Sanidad Ejército (Instituto Nacional de Salud [INS], 2019).
Un adecuado diagnóstico de la leishmaniasis permite elegir un tratamiento apropiado, y un seguimiento y monitoreo conllevarán un excelente pronóstico de la enfermedad. Es por esto que las pruebas de diagnóstico y de seguimiento de un tratamiento deben ser sensibles, específicas, rápidas y asequibles. La reacción en cadena de la polimerasa en tiempo real (qPCR) es un método molecular de diagnóstico clínico, que cumple con los anteriores criterios y es capaz de cuantificar los productos de amplificación de un blanco de ADN mediante el monitoreo en cada ciclo de cuantificación. Esta técnica puede ser usada para monitorear ciertos tratamientos farmacológicos contra leishmaniasis, gracias a lo cual se puede hacer la relación del número de parásitos equivalentes al ADN o la también denominada carga parasitaria. Lo anterior es posible mediante el uso como control interno de un marcador molecular como GAPDH, β-microglobulina, 18S ARNr o ERV3, que permite normalizar la carga parasitaria o el número de parásitos equivalentes a ADN de Leishmania frente al número de células humanas equivalentes también al ADN humano (Romero et al., 2010; De Paiva-Cavalcanti et al., 2013; Jara et al., 2013; Méndez, 2014).
Así mismo, existen marcadores moleculares tales como el gen de la proteína de choque térmico (HSP70) y el gen de la isomerasa manosa fosfato (MPI), que mediante amplificación por PCR convencional, seguido de secuenciación Sanger, permiten identificar por barcoding las especies causantes o agentes etiológicos de la leishmaniasis (Córdova et al., 2011; Ramírez et al., 2016; Patiño et al., 2017). Esto con el fin de poder analizar las dinámicas entre las especies infectantes, el vector, el pronóstico de la enfermedad, los tratamientos farmacológicos suministrados a los pacientes, así como otras variables clínico-epidemiológicas.
En Colombia, como tratamiento farmacológico para la LC, se siguen los lineamientos del Ministerio de Salud y Protección Social a través del Instituto Nacional de Salud (INS), donde se sugiere el antimoniato de meglumina (N-metil glucamina) como medicamento de primera línea, el cual es administrado por vía intramuscular o endovenosa en dosis de 20 mg/kg/día. En caso de falla terapéutica de los antimoniales pentavalentes, se debe administrar como segunda línea de tratamiento miltefosina vía oral de 1,5-2,5 mg/ kg/día durante 28 días o isetionato de pentamidina con una dosis de 3-4 mg/kg/día vía intramuscular o endovenosa en 4 a 10 dosis en días alternos. Si persiste la falla terapéutica, se establece la anfotericina B liposomal intravenosa 2-3 mg/kg/día (Durán et al., 2018).
Este estudio es el primero en sanidad militar en hacer un seguimiento o monitoreo detallado al tratamiento en pacientes del programa de leishmaniasis, mediante la cuantificación del número de parásitos equivalentes a ADN por qPCR al iniciar, durante y al finalizar el tratamiento. Solo un estudio previo había validado y estandarizado la prueba de qPCR amplificando los marcadores moleculares ADNk y G6PD como una técnica diagnóstica asertiva (Méndez, 2014), esto con el fin de disminuir los costos administrativos logísticos no solo en el tiempo de recuperación de los pacientes fuera del área de operaciones, sino en tratamientos de leishmaniasis en el interior de la fuerza.
Los objetivos de este estudio fueron 1) estimar la carga parasitaria de Leishmania spp. en personal militar activo del Ejército Nacional de Colombia con leishmaniasis cutánea bajo tratamiento con antimoniato de meglumina e isetionato de pentamidina, 2) determinar el éxito o fracaso del tratamiento farmacológico actual mediante la relación de la carga parasitaria con diferentes datos clínico-epidemiológicos y 3) identificar molecularmente la especie infectante con su distribución y abundancia en sitios de posible infección.
Marco teórico
La leishmaniasis es un problema creciente de salud pública a nivel mundial. En Colombia, la situación es preocupante debido al incremento de casos de LC que se ha registrado en los últimos años y al cambio en el patrón epidemiológico dado por la aparición de nuevos focos. El proceso creciente de domiciliación y urbanización del ciclo de transmisión es una problemática que afecta especialmente las Fuerzas Militares debido a la misión que cumplen en áreas endémicas de esta zoonosis. El antimoniato de meglumina es el medicamento de elección para el tratamiento de la leishmaniasis cutánea en Colombia y es suministrado por el Ministerio de Protección Social. Según la experiencia de los médicos dermatólogos en el Ejército, es indispensable realizar un seguimiento clínico y de laboratorio a los pacientes tratados con antimoniato de meglumina y otros medicamentos leishmanicidas para conocer el comportamiento terapéutico de acuerdo con la especie y el patrón de susceptibilidad mostrado por los agentes etiológicos de la enfermedad. La resistencia clínica o falla terapéutica a los antimoniales ha aumentado proporcionalmente a la epidemia de forma global. Las tasas de falla oscilan entre el 10 y el 23 % para el tratamiento con antimoniales pentavalentes según el esquema recomendado por la Organización Mundial de la Salud (OMS) (Expert Committee on the Control of the Leishmaniases & World Health Organization, 2010).
El uso de la PCR en tiempo real permite conocer si existe presencia o no del agente etiológico de la leishmaniasis en la muestra procesada. Además, permite detectar y cuan-tificar la carga parasitaria como una medida de diagnóstico que atiende a las necesidades actuales de Salud Operacional del Ejército Nacional de Colombia y OMS. Con esta información se puede conocer la carga parasitaria inicial, la respuesta al tratamiento y se puede realizar un pronóstico sobre la evolución de la enfermedad para predecir a futuro eventos adversos como la LMC.
En Colombia existen pocos estudios relacionados con la cuantificación de carga parasitaria de leishmaniasis cutánea. Uno de ellos (Méndez, 2014) estandarizó una PCR en tiempo real a partir de los blancos moleculares G6PD y A DNk para la cuantificación de la carga parasitaria de Leishmania spp. y se normalizó con el gen humano de copia única ERV3. Uno de los hallazgos más relevantes de tal investigación fue la disminución significativa de la carga parasitaria con el tiempo de evolución de la enfermedad. Esto llevó a la sugerencia de usar esta técnica para evaluar la eficacia de un tratamiento y el pronóstico de resolución de la enfermedad. Otro estudio colombiano (Romero et al., 2010) se centró en la viabilidad parasitaria en sitios extralesionales a partir de transcripciones del marcador molecular 7SLRNA mediante una RT-qPCR, puesto que determinar si el parásito es viable o no en monocitos puede alertar sobre futuras LC y LMC. En otros países de la región, como Perú, se detectó y cuantificó la carga parasitaria de Leishmania spp. en piel y lesiones en mucosas. La qPCR por ADNk demostró ser altamente sensible y precisa para la detección y cuantificación parasitaria a partir de biopsias, y no se encontraron diferencias en la carga parasitaria en relación con las especies de parásitos, la edad del paciente y el número o área de las lesiones (Jara et al., 2013). Otro estudio desarrollado en Perú comparó cuantitativamente las cargas parasitarias entre los diferentes sitios de lesiones en piel y métodos de muestreo mediante el uso de qPCR para proveer una idea de la distribución probable de los amastigotes de Leishmania spp. en la úlcera, y así mejorar el diagnóstico y pronóstico de LC (Suárez et al., 2015). Por último, un estudio en Brasil estimó la carga parasitaria a partir de ADN de ARNr SSU mediante una qPCR en la que se les hizo seguimiento a unos niños con LV antes, durante y al finalizar el tratamiento farmacológico, junto con la identificación de factores de riesgo para un apropiado pronóstico de la enfermedad (Mourão et al., 2014).
Métodos
Consideraciones éticas
El presente estudio corresponde a una investigación de riesgo mínimo de acuerdo con la clasificación expuesta en el artículo 11 de la Resolución 8430 de 1993 del Ministerio de Salud. Fue aprobado bajo Acta n.° 2043 del 22 de marzo del 2017, según el Comité de Ética en Investigación del Hospital Militar Central, Bogotá.
Por su parte, el manejo de todos los datos del paciente, la ficha clínico-epidemiológica y los resultados se realizaron bajo las más estrictas normas de confidencialidad, con la previa autorización del paciente, mediante la aplicación de un consentimiento informado. Se utilizó el consentimiento informado de acuerdo con la Resolución Colombiana 2378 de 2008 sobre Buenas Prácticas Clínicas.
Tipo de estudio
Se definió como observacional descriptivo longitudinal, en el cual se realizó un seguimiento a una cohorte de pacientes con leishmaniasis cutánea bajo tratamiento farmacológico. El estudio contempló la toma de muestra antes, a la mitad y al finalizar el tratamiento, acompañado de una evaluación clínica.
Tamaño de la muestra
Para estimar el tamaño de la muestra, se consideró el número promedio de pacientes atendidos durante un año en Bonza, Boyacá (tratados con antimoniato de meglumina por primera vez) y el Batallón de Sanidad (Basan) de Bogotá (isetionato de pentamidina como tratamiento de segunda elección). Se ajustó incluyendo un número de pacientes promedio anual que repite tratamiento (19 % al 50 %) y usando como criterio de exclusión pacientes con lesión en rostro, según datos disponibles en Salud Operacional de la Dirección de Sanidad Ejército y Sivigila. Un tamaño de muestra n = 139 pacientes (Bonza = 86 pacientes y Basan = 53 pacientes) se estimó en Epi Info v7.2.2.6 (https://www.cdc.gov/epiinfo/index.html), con IC 95 % y un error de muestra esperado del 5 %. Para los análisis del presente estudio se realizaron las correlaciones de las cargas parasitarias con los datos clínico-epidemiológicos, así como el análisis espaciotemporal de las especies circulantes de Leishmania spp. en población militar únicamente con un n = 23 pacientes, que corresponden a las muestras con carga parasitaria elevada y a considerar al finalizar el tratamiento.
El estudio incluyó pacientes de población militar de sexo masculino, mayores de 18 años, con diagnóstico microscópico de leishmaniasis cutánea, que participaron voluntariamente del estudio, con previo consentimiento informado, con un tamaño de lesión de más de 1 cm de diámetro y sin evidencia clínica de sobreinfección bacteriana o micótica de la úlcera al inicio del estudio.
Toma de muestra
Para el caso de las muestras de frotis, se realizó isquemia manual utilizando los dedos pulgar e índice, se raspó de la base y el centro de la úlcera con una lanceta estéril (Suárez et al., 2015). La muestra obtenida se depositó en un vial de tapa-rosca con 250 µL de solución salina estéril. Posteriormente se almacenó a -70 °C hasta su procesamiento. Además, se tomó una muestra de sangre periférica de aproximadamente 3 mL en un tubo con EDTA, seguido de un almacenamiento a 4 °C antes de su pronto procesamiento.
Obtención células mononucleares de sangre periférica (PBMC)
En un tubo de 15 mL se tomaron 7 mL de solución salina estéril 0,85 % y se adicionaron 3 mL de sangre periférica. Se mezclaron por inversión y con vórtex para una mejor homogenización. Posteriormente, en otro tubo de 15 mL se adicionaron 3 mL de ficol y de la mezcla inicial de sangre periférica y solución salina se tomaron 7mL, que fueron transferidos por las paredes del tubo para evitar mezclar la muestra con el reactivo. Se centrifugó la mezcla a 4 °C por 2500 r/min durante 30 min. Luego de la centrifugación, se aspiró la interfaz opaca que contenía las PBMC, se depositó en un vial de 1,5 mL y se almacenó a -20 °C para su posterior procesamiento.
Extracción ADN y cuantificación en BioDrop
La extracción de ADN a partir de las muestras de frotis, biopsias, PBMC y cultivo de Leishmania braziliensis del LRI-DISAN-EJC (MHOM/DR/75/M2904) se realizó mediante cromatografía de adsorción, de acuerdo con las indicaciones del fabricante del kit. La elución final del extracto se llevó a cabo en 60 µL de buffer EL. Seguido a esto, todos los extractos de ADN fueron sometidos a cuantificación por BioDrop uLite Spectrophotometer (Biochrom US, Holliston, MA) aceptando valores iguales o superiores a 4 ng/µL y con relaciones 230/260 (ácidos nucleicos/sales caotrópicas, fenoles o carbohidratos) > 1,0 y < 3,0 mientras 260/280 (ácidos nucleicos/compuestos aromáticos como fenoles, proteínas y ARN) >1,6 y < 3,0.
PCR en tiempo real para el seguimiento del tratamiento
Para la amplificación del minicírculo del ADNk se utilizaron los primers kDNAr (5' TAC TCC CCG ACA TGC 3')y kDNAf (5'GAA CGGGGT TTC TGT ATG C 3') (Jara et al., 2013). Mientras que el gen ERV3 sirvió como normalizador, ya que es de copia única en el genoma humano. Los primers para el ERV3 fueron: PHP10F (5'CATGGGAAGCAAGGGAACTAATG3') y PHP10R (5'CCCAGCGAGCAATACAGAATTT3') (Yuan, et al., 2001; Adaui et al., 2006).
La reacción de la qPCR se corrió en un equipo LightCycler® 96 Roche y previamente la mezcla se preparó según recomendaciones del kit comercial Luna Universal qPCR Master Mix de NewEngland, la cual consistió de 0,2 µ M de cada primer, 12,6 µL de agua grado reactivo biología molecular libre de DNAsas y RNAasas, 0,5 X de la Master Mix y 2 µL de ADN para un volumen final de 20 µL. Las condiciones del termociclado para el ADNk y ERV3 fueron las siguientes: preincubación a 95 °C por 10 min, seguido de 36 ciclos de 95 °C por 20 s, 60 °C por 20 s y 72 °C por 20 s. La emisión de la fluorescencia se midió al final del paso de elongación mediante la sonda de SYBRGreen. Luego de la amplificación se generó una curva melting que consistió en 95 °C por 60 s, 60 °C por 60 s y un calentamiento continuo a 1 °C/s hasta 95 °C (Jara et al., 2013; Méndez, 2014).
Curva estándar, cuantificación de la carga parasitaria y validación qPCR
El ADN genómico de L. braziliensis MHOM/DR/75/M2904 sirvió para el diseño de las curvas estándar de los ensayos de ADNk. Se consideró que 96,3 fg correspondían a ADN nuclear más ADN del quinetoplasto (Peacock et al., 2007; Shapiro & Englund, 1995). Se llevaron a cabo ocho diluciones seriadas desde 105 (4,815 ng/µL) hasta 10-2 (4,815 x 10-7 ng/µL) partiendo de una concentración inicial de ADN genómico de L. braziliensis de 185,5 ng/µL.
Para la normalización de la carga parasitaria se cuantificó en paralelo el número de células humanas mediante el uso del gen de copia única ERV-3. Para tal fin, se construyó una curva estándar con puntos desde 105 (165 ng/µL) hasta 100 (1,65 x 10-3 ng/µL) usando ADN humano con una concentración inicial de 207 ng/µL. Se consideró la masa del genoma humano haploide de 3300 fg. Finalmente, se aplicó la ecuación para obtener la carga parasitaria o número de parásitos/106 células humanas (Jara et al., 2013). Para la validación de las pruebas se realizaron ensayos de sensibilidad por duplicado usando 5 puntos de la curva del ADN puro de L. Braziliensis vs. otro ADN de L. Braziliensis contaminado con 10 ng ADNg humano. Por otro lado, para las pruebas de reproducibilidad se realizaron montajes de la curva del ADNk intra- e interensayo por triplicado, chequeando en todos los casos la eficiencia y R2 de las curvas.
PCR, purificación y secuenciación
La amplificación por PCR convencional de los marcadores HSP70 y MPI en n = 23 a partir de extractos de frotis se llevó a cabo siguiendo los protocolos previamente establecidos (Córdova et al., 2011; Ramírez et al., 2016). Todos los productos fueron verificados mediante gel de agarosa al 1%, teñido con Gel RedTM 1000X y un corrido a 80 V durante 40 minutos en una cámara de electroforesis horizontal con TAE al 1X. Los productos de PCR fueron posteriormente purificados y secuenciados por el método didesoxi terminal en un secuenciador automático AB3730 de Applied Biosystem en Macrogen Korea.
Análisis estadísticos y bioinformáticos
Todos los análisis de estadísticos descriptivos, univariados y multivariados para los pacientes que reportaron cargas parasitarias altas o a considerar al finalizar el tratamiento, fueron desarrollados en IBM SPSS Statistics v25. Pruebas no paramétricas fueron usadas cuando las muestras no seguían distribución gaussiana según la prueba de Shapiro Wilk. Las variables fueron analizadas de acuerdo a su naturaleza categórica o cuantitativa mediante las pruebas de Mann-Whitney U, Kruskal Wallis y correlación de Spearman. Las variables analizadas en este estudio fueron carga parasitaria en frotis/biopsia y PBMC, seguimiento al tratamiento (antes, durante y después), especie infectante (L. braziliensis y L. panamensis), tipo de tratamiento (antimoniato de meglumina e isetionato de pentamidina), área de las lesiones internas y externas, número de lesiones, evolución de la enfermedad, zona de la herida, departamento de posible infección, medidas preventivas como usar toldillo o repelente, edad, grado militar y el éxito o fracaso del tratamiento. Todas las pruebas fueron de dos colas y los resultados se consideraron significativos (*) cuando p < 0,05 y altamente significativos (**) cuando p < 0,01. Un análisis de componentes principales (ACP) se llevó a cabo para los datos de los 23 pacientes que resultaron con cargas parasitarias altas o a considerar al finalizar el tratamiento. Esto se realizó mediante el método de correlaciones con matriz de rotación varimax para maximizar la varianza de cada uno de los factores, así como con matriz de correlaciones Anti-Image. El ACP fue validado por las pruebas de Kaiser-Meyer-Olkin y esfericidad de Bartlett, de esta forma se agruparon varias variables discretas y continuas en tres componentes principales que explicaban más del 60 % de la varianza de los datos. Se aceptaron como variables con alto aporte a los componentes aquellas que tuvieron correlaciones < - 0,5 o > 0,5.
Los análisis bioinformáticos para identificar molecularmente la especie infectante de Leishmania spp. fueron realizados en BLASTn (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE_TYPE=BlastSearch), buscando similaridad con el porcentaje de identidad > 98 %, el score y el e-value cercano a 0,0 entre las secuencias obtenidas de este estudio versus la base de datos de secuencias disponibles de Leishmania spp. en GenBank.
Resultados
Cuantificación carga parasitaria
Se estimó la carga parasitaria de Leishmania spp. en 23 hombres del personal militar activo del Ejército Nacional de Colombia con leishmaniasis cutánea a partir de muestras de PBMC y frotis/biopsia analizadas por qPCR. Para estas últimas se identificó que solo el 8,82 % (12/136) de los pacientes muestreados inicialmente en el estudio presentaron un número > 10.000 parásitos / 106 células humanas al finalizar este. En la figura 1A se muestra la efectividad del tratamiento de antimoniato de meglumina e isetionato de pentamidina antes, durante y después en los 23 pacientes que presentaron carga parasitaria elevada en frotis/biopsia al finalizar este.

Fuente: Elaboración propia
Figura 1 Media de la carga parasitaria durante el seguimiento de los tratamientos de leishmaniasis cutánea: antimoniato de meglumina vs. isetionato de pentamidina, mediante el marcador molecular ADNk en 23 pacientes que presentaron carga parasitaria elevada o a considerar al finalizar el tratamiento. (A) Carga parasitaria estimada a partir de muestras de frotis y biopsias de lesiones. (B) Carga parasitaria estimada a partir de células mononucleares de sangre periférica (PBMC). ISSN 1900-6586 (impreso), 2500-7645 (en línea)
Con respecto al número de parásitos/106 PBMC, al finalizar el tratamiento solo 9,56 % (13/136) presentaron cargas parasitarias > 1,0. En la figura 1B es posible ver el efecto del seguimiento al tratamiento (antes, durante y después) y el tipo de tratamiento (antimoniato de meglumina vs. isetionato de pentamidina) sobre la carga parasitaria a considerar en PBMC de los 23 pacientes analizados.
Las cargas parasitarias del total de pacientes muestreados (n = 136) no se reportan, puesto que en este estudio solo se analizaron y reportaron datos de 23 pacientes con cargas parasitarias elevadas y de importancia para el diagnóstico molecular en leishmaniasis.
Relación cargas parasitarias y datos clínico-epidemiológicos
Dentro de las variables clínico-epidemiológicas cuantitativas que se analizaron, están la edad, el número de lesiones, la evolución de la enfermedad, el área interna y externa de la lesión (tabla 1). Variables que junto con las cargas parasitarias en frotis/biopsia y PBMC fueron evaluadas por estadísticos descriptivos para el subgrupo de los 23 pacientes que presentaron cargas parasitarias elevadas o a considerar al finalizar el tratamiento farmacológico (tabla 2). Asimismo, se determinó el efecto del tipo de tratamiento como del seguimiento del tratamiento sobre las cargas parasitarias en frotis/biopsia y PBMC (figura 1).
Tabla 1 Resumen de estadísticos descriptivos de datos clínico-epidemiológicos para los 23 pacientes del estudio
| Edad | Número de lesiones | Evolución de la enfermedad (meses) | |||||
|---|---|---|---|---|---|---|---|
| n | = 23 | n = 23 | AM | IP | |||
| n = 14 | n = 5 | ||||||
| Máximo | 36,0 | 13,0 | 3,00 | 7,00 | |||
| Media | 24,78 | 2,30 | 1,39 | 4,30 | |||
| Mediana | 24 | 1,0 | 1,25 | 4,00 | |||
| Varianza | 15,27 | 10,68 | 0,47 | 6,20 | |||
| Mínimo | 19,0 | 1,0 | 0,50 | 0,50 | |||
| Antes | Durante | Después | |||||
| AM | IP | AM | IP | AM | IP | ||
| n = 17 | n = 6 | n = 16 | n = 6 | n = 11 | n = 6 | ||
| Máximo | 24,00 | 22,50 | 32,50 | 7,50 | 26,5 | 6,96 | |
| Media | 4,24 | 4,32 | 3,62 | 1,74 | 3,44 | 1,60 | |
| Área de lesión | Mediana | 0,90 | 0,68 | 0,85 | 0,76 | 0,64 | 0,56 |
| interna (cm2) | Varianza | 56,36 | 79,67 | 63,82 | 8,12 | 59,78 | 0,33 |
| Mínimo | 0,18 | 0,12 | 0,07 | 0,09 | 0,09 | 0,09 | |
| n = 13 | n = 5 | n = 17 | n = 6 | n = 11 | n = 6 | ||
| Máximo | 75,00 | 42,00 | 48,00 | 41,25 | 33,00 | 24,00 | |
| Media | 10,91 | 13,50 | 6,42 | 10,47 | 5,95 | 7,44 | |
| Área de lesión externa (cm2) | Mediana | 4,40 | 3,84 | 2,60 | 5,64 | 2,88 | 4,44 |
| Varianza | 420,20 | 319,62 | 137,54 | 239,25 | 92,16 | 75,31 | |
| Mínimo | 0,80 | 0,42 | 0,25 | 0,30 | 0,25 | ||
AM = antimoniato de meglumina
IP = isetionato de pentamidina
Fuente: Elaboración propia
Tabla 2 Resumen de estadísticos descriptivos de cargas parasitarias en frotis/biopsia y PBMC para los 23 pacientes del estudio
| Antes | Durante | Después | |||||
|---|---|---|---|---|---|---|---|
| AM | IP | AM | IP | AM | IP | ||
| n = 17 | n = 6 | n = 17 | n = 6 | n = 17 | n = 6 | ||
| Carga parasitaria en frotis/biopsia (número parásitos / 106 células humanas) | Máximo | 1,27 x 107 | 2,80 x 106 | 9,37 x 106 | 4,25 x 106 | 2,68 x 105 | 3,39 x 106 |
| Media | 3,28 x 106 | 1,01 x 106 | 6,58 x 105 | 8,57 x 105 | 3,23 x 104 | 5,72 x 105 | |
| Mediana | 2,12 x 106 | 2,01 x 105 | 3,87 x 104 | 6,55 x 104 | 1,04 x 104 | 8,51 x 103 | |
| Varianza | 1,70 x 1013 | 1,94 x 1012 | 5,08 x 1012 | 2,85 x 1012 | 4,20 x 109 | 1,91 x 1012 | |
| Mínimo | 7.01 x 103 | 2.21 x 103 | 7,37 x 101 | 3,13 x 101 | 1,89 x 100 | 4,30 x 102 | |
| Carga parasitaria en PBMC (número parásitos 106 células humanas | Máximo | 2,58 x 100 | 3,13 x 101 | 9,57 x 100 | 1,20 x 100 | 2,40 x 100 | 5,55 x 100 |
| Media | 1,15 x 100 | 5,73 x 100 | 1,68 x 100 | 8,80 x 10-1 | 1,06 x 100 | 1,52 x 100 | |
| Mediana | 1,05 x 100 | 6,47 x 10-1 | 6,69 x 10-1 | 1,06 x 100 | 1,12 x 100 | 7,16 x 10-1 | |
| Varianza | 5,54 x 10-1 | 1,57 x 102 | 6,19 x 100 | 2,03 x 10-1 | 6,37 x 10-1 | 4,14 x 100 | |
| Mínimo | 0 | 2,00 x 10-2 | 0 | 0 | 0 | 2,00 x 10-1 |
AM = antimoniato de meglumina
IP = isetionato de pentamidina
Fuente: Elaboración propia
Por otro lado, de acuerdo con las pruebas de normalidad realizadas por Shapiro-Wilk a las variables cuantitativas del estudio para el n = 23, se determinó lo siguiente: las cargas parasitarias en frotis/biopsia (S-W = 0,495, p = 0,00) y PBMC (S-W = 0,641, p = 0,00) no tienen una distribución normal, así como tampoco las áreas de lesiones internas (S-W = 0,487,p = 0,000), externas (S-W = 0,621,p = 0,000), el número de lesiones (S-W = 0,446,p = 0,000) y evolución de la enfermedad (S-W = 0,641,p = 0,000). La única variable demográfica cuantitativa evaluada que refiere ser de distribución normal es la edad de los pacientes (S-W = 0,945, p = 0,699).
Se llevó a cabo una prueba no paramétrica o ANOVA de 1 vía por Kruskal Wallis para todas las variables de distribución no normal, donde se determinó que hay diferencias significativas (p = 0,000) entre las cargas parasitarias de frotis/biopsia de acuerdo con el tiempo en el seguimiento del tratamiento (antes, durante y después), asimismo el tipo de tratamiento tiene un efecto sobre la evolución de la enfermedad (p = 0,00). Por el contrario, no se encontraron diferencias significativas en las cargas parasitarias en PBMC (p = 0,784), el área de lesión interna (p = 0,949) y externa (p = 0,708) de acuerdo con el tiempo en el seguimiento del tratamiento. Tampoco hubo diferencias significativas en las cargas parasitarias en frotis/biopsia y PBMC en relación con el tipo de especie infectante y el tipo de tratamiento farmacológico. No se encontró efecto significativo del grado militar del paciente, zona de la herida, departamento de posible infección o medidas preventivas como usar toldillo o repelente sobre la carga parasitaria, área de las lesiones internas o externas, la evolución de la enfermedad, el número de lesiones y el éxito o fracaso del tratamiento.
Se encontró una correlación negativa y altamente significativa para las cargas parasitarias al finalizar el tratamiento de frotis versus PBMC de acuerdo al coeficiente Rho de Spearman: -0,560** (p = 0,005). Las cargas parasitarias en L. braziliensis presentan una mayor dispersión frente a las cargas parasitarias en L. panamensis (figura 2). Del mismo modo, se reportó una correlación negativa significativa del seguimiento clínico a través del área externa de la lesión versus el seguimiento de la carga parasitaria en frotis. Esto significa que cuando las cargas parasitarias en frotis disminuyen durante el seguimiento, el área de la lesión externa en estos pacientes va aumentando (figura 3). Por el contrario, se da una correlación positiva altamente significativa entre el seguimiento de la carga parasitaria en PBMC versus el seguimiento al área externa de la lesión (Rho Spearman: 0,489** p = 0,000) y el seguimiento al área interna de la lesión (Rho Spearman: 0,335**p = 0,004). Las lesiones internas versus externas están altamente correlacionadas de forma positiva durante todo el seguimiento al tratamiento (Rho Spearman: 0,686** p = 0,000).

Fuente: Elaboración propia
Figura 2 Correlación de Spearman entre la carga parasitaria de Leishmania spp. en PBMC versus frotis/biopsia al finalizar el tratamiento farmacológico. n = 23. Rho de Spearman: -0,560** (p = 0,005). En rombos se resaltan las muestras a las que no se les identificó molecularmente el agente etiológico.

Fuente: Elaboración propia
Figura 3 Correlación de Spearman entre la carga parasitaria en frotis/biopsia versus el área de lesión externa con base en el tratamiento farmacológico antes, durante y al finalizar los 20 días. n = 23. Rho Spearman: -0,264* p = 0,044.
Con respecto a la prueba no paramétrica de U Mann Whitney, se determinó que las cargas parasitarias de frotis (U M-W = 126,5**) y la evolución de la enfermedad (U M-W = 76,5*) son diferentes para quienes resolvieron versus quienes no resolvieron la leishmaniasis. Por el contrario, no hubo diferencias significativas para las cargas parasitarias en PBMC, áreas de lesión interna, externa y número de lesiones con respecto a los pacientes que resolvieron la enfermedad versus quienes no. También se encontró que la especie infectante no influye en ninguna variable cuantitativa no paramétrica del estudio. El tipo de tratamiento tiene un efecto en las diferencias reportadas para la evolución de la enfermedad (U M-W = 114,0**).
La edad representó la única variable normal, por tanto, se determinó mediante una t-Student que no hubo diferencias significativas entre sus medias en relación con la especie infectante, tratamiento recibido y resolución según criterio médico.
Dado que no todos los análisis univariados arrojaron datos significativos para todas las variables, se procedió con análisis multivariados, donde se agruparon siete variables en tres componentes principales (CP) que explicaban el 72,66 % de la varianza de los datos. La validación del ACP se consiguió con una medida de Kaiser-Meyer-Olkin de adecuación del muestreo (KMO = 0,604), que está por encima de 0,6 valor mínimo sugerido. Adicionalmente, la prueba de esfericidad de Bartlett estimó un %2 = 83,023**, lo que significa que hay una alta correlación entre las variables.
En el CP 1 se obtuvieron las siguientes variables con correlaciones > 0,5: edad, evolución de la enfermedad y carga parasitaria en PBMC. El CP 2 contuvo las variables con correlaciones > 0,5: área interna de la lesión y área externa de la lesión. El CP 3 reunió las variables con correlaciones > 0,5: carga parasitaria en frotis/biopsia y número de lesiones. Es así como se resolvió que las áreas interna y externa de la lesión agrupadas en el CP 2 están explicando diferencias a nivel de especie infectante (figura 4). Por el contrario, ni la edad, ni la evolución de la enfermedad, ni las cargas parasitarias en frotis/biopsia y PBMC, ni el número de lesiones agrupadas en los CP 1 y CP 3 están explicando diferencias entre Leishmania spp.
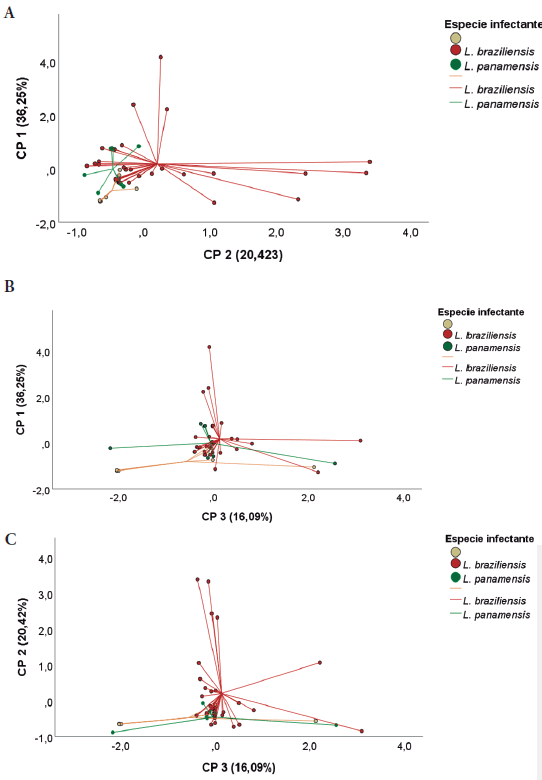
Fuente: Elaboración propia
Figura 4 Análisis de componentes principales (ACP) en relación con la especie de Leishmania spp. antes, durante y al finalizar los 20 días del tratamiento farmacológico. El componente principal 1 (CP 1) explica el 36,15 % de la variación de los datos, el CP 2 explica el 20,42 % de la varianza y el CP 3 el 16,09 %. Figura 4A: El ACP del CP 1 y CP 2 explica el 56,57 % del modelo. Se observan diferencias en los centroides de las especies infectantes según el CP 2. Figura 4B: El ACP del CP 1 y CP 3 explica el 52,34 % del modelo. Se reportan diferencias sustanciales en los centroides de las especies infectantes de acuerdo con ambos componentes. Figura 4C: El ACP del CP 2 y CP 3 explica el 36,51 % del modelo. Se presentan diferencias en los centroides de las especies infectantes con base en el CP 2.
Todas las interacciones de las variables altamente correlacionadas y agrupadas en los CP 1, CP 2 y CP 3 explican diferencias entre los tratamientos farmacológicos suministrados a los 23 pacientes evaluados (figura 5). Por otro lado, la carga parasitaria en frotis/ biopsia y el número de lesiones agrupadas en el CP 3 explican las diferencias entre el momento antes de suministrar el medicamento y los seguimientos durante y después de 20 días (figura 6).

Fuente: Elaboración propia
Figura 5 Análisis de componentes principales (ACP) en relación con el tratamiento farmacológico suministrado antes, durante y al finalizar los 20 días. Figura 5A: Se representan diferencias en los centroides de los tratamientos farmacológicos según CP 1 y CP 2. Figura 5B: Se reportan diferencias sustanciales en los centroides de los tratamientos farmacológicos de acuerdo con los CP 1 y CP 3. Figura 5C: Se presentan diferencias en los centroides de los tratamientos farmacológicos con base en el CP 2 y CP3.

Fuente: Elaboración propia
Figura 6 Análisis de componentes principales (ACP) en relación con el seguimiento realizado al tratamiento. El CP 3 explica las diferencias entre la toma de muestra antes versus durante y después, mientras el CP 1 no explica ninguna diferencia entre los tres seguimientos realizados al tratamiento farmacológico. Los CP 1 y CP 2 no explican ninguna diferencia dada entre los tiempos de seguimiento al tratamiento farmacológico.
Con el apoyo del personal médico dermatológico del programa de leishmaniasis, se determinó si el paciente resolvió o no la enfermedad. Para esta variable, el ACP concluyó que la edad del paciente, la evolución de la enfermedad y la carga parasitaria en PBMC agrupadas en el CP 1, junto con la carga parasitaria en frotis/biopsia y el número de lesiones agrupadas en el CP 3, están explicando las diferencias entre si hay resolución o no de la leishmaniasis según criterio médico (figura 7).

Fuente: Elaboración propia
Figura 7 Análisis de componentes principales (ACP) en relación con la resolución según criterio médico antes, durante y al finalizar los 20 días del tratamiento farmacológico. Figura 7A: Se representan diferencias en los centroides de si se resolvió o no se resolvió únicamente por el CP 1. Figura 7B: Se reportan diferencias sustanciales en los centroides de si se resolvió o no se resolvió de acuerdo con los CP 1 y CP 3. Figura 7C: Se presentan diferencias en los centroides de si se resolvió o no se resolvió con base en el CP3.
Los pacientes que representaron el 8,82 % (n = 12) en frotis/biopsia y 9,56 % (n = 13) en PBMC con carga parasitaria elevada o a considerar al finalizar los tratamientos se muestran en la tabla 3. De los 23 pacientes que presentan carga parasitaria elevada o a considerar al finalizar el tratamiento, el 26,1 % corresponden a los de falla terapéutica con antimoniato de meglumina y por tanto recibieron segunda línea con isetionato de pentamidina. El 69,6 % corresponde a pacientes infectados con L. braziliensis, así como el 17,4 % a quienes según criterio médico no resolvieron la enfermedad en su momento (tabla 3).
Tabla 3 Pacientes con leishmaniasis cutánea que presentan carga parasitaria elevada o a considerar al finalizar el tratamiento (n = 23)
| Número de parásitos/106 células humanas en frotis/biopsia > 10000 (n = 12) | |||||||
|---|---|---|---|---|---|---|---|
| Código paciente | † Carga final en frotis/biopsia | Resolución | |||||
| Tratamiento farmacológico | Especie infectante | según criterio médico | |||||
| BON 97 | Antimoniato de meglumina | L. braziliensis | 10385,77 | Sin dato | |||
| BAS 126 | Isetionato de pentamidina | L. braziliensis | 10676,08 | No resolvió | |||
| BON 41 | Antimoniato de meglumina | L. panamensis | 16806,51 | No resolvió | |||
| BAS 03 | Antimoniato de meglumina | L. braziliensis | 19750,45 | Resolvió | |||
| BAS 26 | Isetionato de pentamidina | Sin dato | 26533,33 | Resolvió | |||
| BON 12 | Antimoniato de meglumina | L. braziliensis | 26758,03 | Resolvió | |||
| BON 21 | Antimoniato de meglumina | L. braziliensis | 31063,83 | Resolvió | |||
| BON 72 | Antimoniato de meglumina | L. panamensis | 34155,6 | Resolvió | |||
| BON 26 | Antimoniato de meglumina | L. braziliensis | 36448,89 | Sin dato | |||
| BON 15 | Antimoniato de meglumina | L. braziliensis | 90136,99 | No resolvió | |||
| BON 90 | Antimoniato de meglumina | Sin dato | 268045,11 | No resolvió | |||
| BAS112 | Isetionato de pentamidina | L. braziliensis | 3390449,44 | Resolvió | |||
| Número de parásitos/106 células humanas en PBMC > 1,00 (n = 13) | |||||||
| Código paciente | Tratamiento farmacológico | Especie infectante | † Carga final en PBMC* | Resolución según criterio médico | |||
| BON 101 | Antimoniato de meglumina | L. braziliensis | 1,01 | Resolvió | |||
| BAS 110 | Isetionato de pentamidina | L. braziliensis | 1,028 | Resolvió | |||
| BON 77 | Antimoniato de meglumina | L. braziliensis | 1,11 | Resolvió | |||
| Número de parásitos/106 células humanas en PBMC > 1,00 (n =13) | |||||||
| BON 75 | Antimoniato de meglumina | L. braziliensis | 1,17 | Sin dato | |||
| BAS 130 | Isetionato de pentamidina | L. panamensis | 1,52 | Resolvió | |||
| BON 102 | Antimoniato de meglumina | Sin dato | 1,59 | Sin dato | |||
| Número de parásitos/106 células humanas en PBMC > 1,00 (n =13) | |||||||
| Código paciente | Tratamiento farmacológico | Especie infectante | † Carga final en PBMC* | Resolución según criterio médico | |||
| BON 49 | Antimoniato de meglumina | L. braziliensis | 1,6 | Resolvió | |||
| BON 97 | Antimoniato de meglumina | L. braziliensis | 1,68 | Sin dato | |||
| BON 06 | Antimoniato de meglumina | L. braziliensis | 1,79 | Sin dato | |||
| BON 96 | Antimoniato de meglumina | L. braziliensis | 1,83 | Resolvió | |||
| BON 69 | Antimoniato de meglumina | Sin dato | 2,16 | Resolvió | |||
| BON 90 | Antimoniato de meglumina | Sin dato | 2,4 | No resolvió | |||
| BAS 128 | Isetionato de pentamidina | L. braziliensis | 5,55 | Resolvió | |||
† La carga final se puede comprender como el número de parásitos equivalentes al número de copias amplificadas por PCR en tiempo real de ADNk en Leishmania spp. en relación con 106 células humanas de acuerdo con la amplificación por PCR en tiempo real del gen normalizador ERV3.
* Células mononucleares de sangre periférica (PBMC).
En gris se resaltan los pacientes BON 90 y BON 97, quienes presentaron un número de parásitos equivalentes a ADNk altas tanto en frotis/biopsia como en células mononucleares de sangre periférica al finalizar el tratamiento.
Fuente: Elaboración propia
Hubo dos pacientes (BON 90 y BON 97) que coincidieron en cargas elevadas y a considerar tanto en frotis/biopsia como en PBMC (figura 8). La resolución, según criterio médico, para el paciente BON 90 fue que no se resolvió con éxito la LC y, por tanto, se remitió a medicina interna. Así mismo, los pacientes BON 15, BON 41 y BAS 126 fueron remitidos a segunda y tercera línea de tratamiento con isetionato de pentamidina y anfotericina B liposomal respectivamente (figura 9). Adicionalmente, al paciente BAS 126 se le administró antimoniato de meglumina intralesional junto con termoterapia como alternativa terapéutica condicionada a criterio médico (Durán et al., 2018). También, los pacientes BAS 112 y BAS 128 se resaltan porque presentaron las cargas parasitarias más altas al finalizar el seguimiento al tratamiento en frotis y PBMC respectivamente (figura 10).

Fuente: Elaboración propia
Figura 8 Lesiones en pacientes que presentaron cargas parasitarias elevadas o a considerar tanto en frotis como en PBMC. BON 90: soldado regular de 20 años de edad, quien refiere infectarse en Campoalegre, Guainía, con una úlcera en el brazo izquierdo. BON 97: soldado profesional de 30 años, con úlcera en el antebrazo izquierdo, de posible lugar de infección en San José del Guaviare, Guaviare. En el seguimiento del tratamiento se evidencia que las lesiones se activaron durante el tratamiento.

Fuente: Elaboración propia
Figura 9 Lesiones en pacientes que no resolvieron según criterio médico al finalizar el tratamiento. BON 15: subteniente, de 25 años de edad, con lesión ulcerada, ubicada en la región mastoidea, con posible lugar de infección La Macarena, Meta. BON 41: soldado profesional de 19 años, con una úlcera en la mano derecha; el paciente refiere haberse infectado en Puerto Caicedo, Putumayo. BON 126: cabo primero de 30 años, con una úlcera en al antebrazo izquierdo, de posible lugar de infección en San José del Guaviare, Guaviare. Ninguna de las lesiones de estos tres pacientes disminuyó de tamaño como para ser considerada la curación médica.

Fuente: Elaboración propia
Figura 10 Lesiones en pacientes que presentaron las cargas parasitarias en frotis (BAS112) y en PBMC (BAS128) más altas al finalizar el seguimiento al tratamiento. BAS112: soldado profesional, de 24 años de edad, con lesión en placa ubicada en el cuello y de posible lugar de infección en San José del Guaviare. El aspecto de la lesión cambió durante el tratamiento a placa verrugosa. BAS128: sargento segundo, de 36 años de edad, con una lesión ulcerada en el codo con presencia de reacción inflamatoria, que cedió durante el tratamiento. Refiere haberse infectado en El Retorno, Guaviare, sin cambio en el área de la lesión al finalizar tratamiento (42 mm2 aproximadamente).
Identificación molecular y análisis espacio temporal de Leishmania spp. en Colombia
Por su parte, se logró amplificar y secuenciar apropiadamente por HSP70 y MPI el 82,6 % (n = 19) de los 23 pacientes del estudio. Se identificaron molecularmente las especies infectantes de Leishmania spp. que circulan en esta particular población militar, que ha sido atendida bajo el programa de leishmaniasis en Bonza, Boyacá y Basan, Bogotá en los años 2017 y 2019. La muestra de interés presentó una abundancia relativa espacial de 84,21 % para L. braziliensis y 15,78 % para L. panamensis. Con respecto al análisis temporal, solo se tienen 14 muestras del 2017 y cinco del 2019. Para el 2017 se obtuvo una abundancia relativa de 85,71 % (n = 12) para L. braziliensis, mientras que para el 2019 fue del 80 % (n = 4). L. braziliensis fue reportada en tres departamentos con distribución exclusiva en las regiones de la Orinoquía y Amazonía, mientras L. panamensis presentó una distribución con reporte en tres departamentos que representan las regiones Pacífica y Amazonía. En ningún departamento de esta muestra se reportaron ambas especies de Leishmania circulando (figura 11).
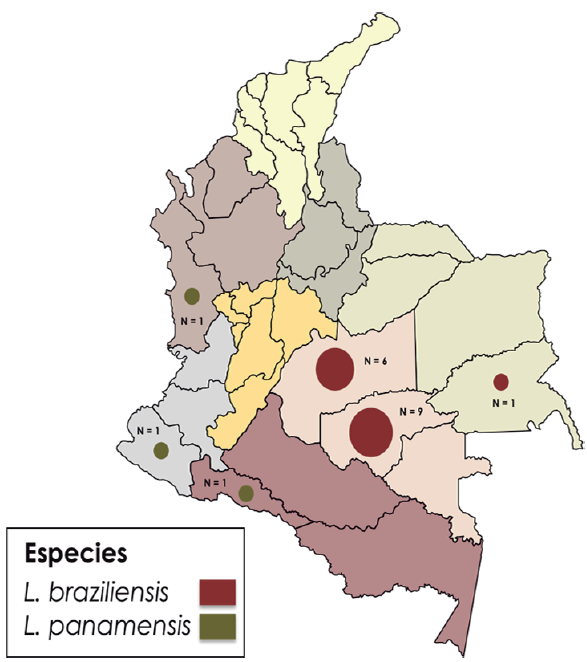
Fuente: Elaboración propia
Figura 11 Distribución y abundancia de especies de Leishmania spp. en 19 hombres del Ejército Nacional de Colombia con cargas parasitarias elevadas y a considerar al finalizar el tratamiento farmacológico. La identificación molecular de especie del parásito se realizó mediante BLASTn con % de identidad superiores a 98 %, a partir de secuencias de HSP70 y MPI obtenidas por amplificación por PCR y secuenciación didesoxi terminal para las muestras de frotis del estudio.
Discusión
Cuantificación de la carga parasitaria
Es de considerar que los pacientes tratados con antimoniato de meglumina por primera vez presentan cargas parasitarias en promedio altas en las lesiones en piel, pero muy bajas en PBMC. Lo contrario pasa en los pacientes tratados con isetionato de pentamidina, que inician con cargas parasitarias no muy altas en úlceras de piel, pero sí en promedio significativas en sangre (figura 1). Esto podría estar sugiriendo la diseminación hematógena o linfática y, por tanto, la circulación de Leishmania spp. en sangre una vez hay falla terapéutica y se remite el paciente a segundo esquema de tratamiento (Romero et al., 2010).
Las cargas parasitarias al finalizar el tratamiento en frotis de los pacientes estuvieron entre 104 y 106, considerándose que 3.390.449,44 parásitos/1.000.000,00 células humanas en el paciente BAS 112 (tabla 3) representa un valor muy alto. Dependiendo de la virulencia de la especie infectante, el sistema inmunológico del paciente (entre muchos otros factores patógeno/hospedero) podría significar un riesgo de leishmaniasis mucocutánea a futuro, forma que se presenta en un gran número de casos, por la reactivación de parásitos circulantes en sangre bajo las condiciones previamente mencionadas (Machado et al., 1992; Conceição-Silva et al., 2018). Cabe mencionar que, aunque el paciente BAS112 presentó un carga baja o insignificante de 2,02 x 10-1 parásitos/106 células humanas de PBMC, esto no significa que los parásitos que subyacen en la lesión al finalizar el tratamiento no se diseminen a través del torrente sanguíneo (Souza et al., 2017).
Por el contrario, el paciente BAS 128 presentó, al finalizar el tratamiento, una carga de 5,55 x 100 parásitos/106 células humanas de PBMC y de 6,32 x 103 parásitos/106 células de frotis. Nosotros sugerimos que se le haga un seguimiento y control al paciente BAS 128 por los siguientes dos años para prevenir o tratar a tiempo una LMC, puesto que cargas parasitarias en PBMC y frotis significativos alertan al personal del área de la salud al demostrar que el paciente finalizó el tratamiento con un concepto de "Resolvió" según criterio médico.
Varios estudios han sugerido que la presencia de Leishmania ARN virus (LRV-1), un virus endógeno reportado entre otras especies en L. braziliensis, induce la expresión del interferón tipo 1, la regulación negativa de los receptores IFN-y por los macrófagos y el reconocimiento por el receptor TLR3, lo que significa que tiene un efecto en procesos de inflamación y respuesta inmunológica, así como que le otorga mayor habilidad para sobrevivir en un ambiente hostil como lo es el torrente sanguíneo (Ives et al., 2011; Macedo et al., 2016; Rossi & Fasel, 2017). También se ha encontrado una relación significativa entre la falla terapéutica o no resolución según criterio médico frente a los casos de pacientes positivos para LRV-1 (Bourreau et al., 2016). Esto abre la posibilidad de evaluar a futuro la presencia de LRI-1 en muestras de personal militar con concepto de "no resolvió" o falla terapéutica para LC, así como en pacientes de LMC. Esto se suma a que, según la Dirección de Sanidad del Ejército, se presentan fallas en el tratamiento en un 13 % de los pacientes de LC.
También se debe considerar que la tercera carga parasitaria evaluada en este estudio fue al finalizar la dosis del tratamiento farmacológico y no del tratamiento en sí, que según lineamientos para la atención clínica integral de leishmaniasis en Colombia del Ministerio de Salud y Protección Social es de 45 días después de terminado el tratamiento, tiempo en el que se estima que el paciente se recuperará en su totalidad (Durán et al., 2018). Adicional a esto, el medicamento es excretado a través de la orina en forma de antimoniato pentavalente, pero sigue circulando en el cuerpo del paciente y, pasados diez días, aún se alcanzan concentraciones de 0,3-0,1 mg/ml en sangre, según estudios de farmacocinética (Jaramillo-González, 2017). Esto significa que las concentraciones parasitarias en frotis y en sangre podrían seguir disminuyendo un poco debido al efecto residual del medicamento que queda en el torrente sanguíneo.
Es de resaltar que, en el continente americano, la LMC está fuertemente correlacionada con L. braziliensis (Schwartz et al., 2006; Cincurá et al., 2017). Es por esto que también se sugiere hacerle un seguimiento clínico y preventivo a los 15 pacientes a los que se les identificó molecularmente esta especie infectante y presentan cargas parasitarias elevadas o a considerar al finalizar el tratamiento, tanto en frotis/biopsia como en PBMC (tabla 3). Sin embargo, no hay que descartar el resto de pacientes reportados acá, puesto que estudios previos en Colombia han notificado casos de LMC provocados por L. panamensis (Osorio et al., 1998), y en otros estudios de Brasil se ha observado en pacientes infectados con L. amazonensis, L. guyanensis y L. peruviana (Cincurá et al., 2017). Actualmente, el Grupo de Investigación en Enfermedades Tropicales del Ejército (GINETEJ) se encuentra haciendo un análisis de viabilidad del parásito a partir de la amplificación del marcador 7SLRNA mediante una RT-qPCR (Romero et al., 2010), esto con el fin de corroborar si los parásitos que circulan en la sangre de estos pacientes están vivos, lo cual podría significar la causa de una reactivación de LC o una LMC a futuro. Mientras tanto, se realizó un reporte al personal médico dermatológico relacionando los 23 pacientes con cargas parasitarias altas, enmarcándose en los propósitos del proyecto de investigación y del compromiso con los participantes.
Las 23 muestras analizadas en este estudio contaron con cargas parasitarias de entre 105 y 107 al iniciar el tratamiento, valores que están dentro del rango normal de reporte según estudios previos para el minicírculo del ADNk en Leishmania spp. (Jara et al., 2013; Méndez, 2014). Sumado a esto, la cuantificación de la carga parasitaria por el minicírculo del ADNk como estimativo del número de parásitos equivalentes al ADN apoya muy bien el diagnóstico y el promisorio seguimiento al tratamiento (Moreira et al., 2018), por lo cual se sugiere que se implemente a futuro en el Ejército para disminuir los costos en la logística militar de tratamientos médicos en LC.
La correlación negativa significativa de las cargas parasitarias en frotis y PBMC al finalizar el tratamiento puede explicarse por el hecho de que los parásitos, una vez se diseminan por el torrente sanguíneo, disminuyen en el área de la lesión, mientras que cuando están exacerbados en la lesión, aún no han realizado migración al torrente sanguíneo. Con respecto a la correlación negativa significativa entre el área de la lesión externa y la carga parasitaria en frotis, se podría sugerir que lesiones con áreas grandes presentan menos carga parasitaria debido a la microbiota concomitante en la herida que puede afectar negativamente la abundancia de la especie infectante, y a que este signo en la piel se relaciona más con la respuesta inmunológica del paciente que con el número de parásitos infectantes (Antonelli et al., 2005; Kip et al., 2015).
Varios autores han resaltado que la infectividad de Leishmania spp. puede ser multifactorial. En este estudio se reportó que hay diferencias en el tipo de especie infectante que se explican por el área interna y externa de las lesiones, lo cual es coherente con variaciones intra- e interespecíficas en relación con las manifestaciones clínicas (Conceição-Silva et al., 2018). Con respecto al tratamiento farmacológico, se explican diferencias entre antimoniato de meglumina e isetionato de pentamidina, dado el conjunto de las siete variables como edad, evolución de la enfermedad, carga parasitaria en PBMC, área interna de la lesión, área externa de la lesión, carga parasitaria en frotis/biopsia y número de lesiones. Esto corrobora, por ejemplo, que las cargas parasitarias se ven altamente diferenciadas, dado que los pacientes sometidos a isetionato de pentamidina provenían de una exposición previa a antimoniato de meglumina, por lo que su número de parásitos en frotis/ biopsia y PBMC iba a ser significativamente más bajo.
Las diferencias en el seguimiento al tratamiento (antes, durante y después) pueden explicarse debido a la eficacia de los medicamentos para tratar la leishmaniasis. Sin embargo, según los ACP, no hubo diferencias entre el seguimiento durante y después, esto puede deberse a que los 23 pacientes analizados fueron pacientes que, según la cuantificación de la carga parasitaria, no habían resuelto la enfermedad. Finalmente, con respecto a la resolución según criterio médico, hay diferencias entre los pacientes que resolvieron versus quienes no lo hicieron, lo que puede explicarse porque presentan diferencias entre las áreas de sus lesiones, las cargas parasitarias y el número de lesiones.
Identificación molecular y análisis espaciotemporal de Leishmania spp. en Colombia
Como estudios anteriores habían reportado, en población militar la especie infectante con mayor abundancia relativa es L. braziliensis (84,21 %), mientras que en población civil es L. panamensis (Patiño et al., 2017). Con respecto al estudio de Patiño y colaboradores (2017), se observó un aumento del 23,11 % en la abundancia relativa de L. braziliensis en población militar y una disminución en la riqueza, puesto que en este estudio no fueron reportados L. guyanensis, L. mexicana y L. lainsoni. Estas tres especies no reportadas acá representaban una abundancia relativa de 5,4 % en Patiño y colaboradores (2017). Cabe mencionar que en nuestro estudio el tamaño de la muestra fue significativamente más baja con respecto al estudio previo y que para el departamento del Meta solo se reportaron 6 pacientes del total de 19 a los que se les identificó la especie de Leishmania, mientras que en Patiño et al. (2017) fueron 131 pacientes notificados con probable infección en el Meta de un total de 272 pacientes muestreados para Colombia.
Conclusiones
En conclusión, se estimó la carga parasitaria de Leishmania spp. en 23 hombres militares colombianos sometidos a dos esquemas de tratamiento diferentes, lo que permitió determinar, a través de las diferencias significativas en el seguimiento, que son esquemas muy eficaces para tratar la leishmaniasis cutánea en el Ejército Nacional. Se definió el éxito del tratamiento farmacológico en términos de diferencias significativas entre los que resuelven y no la enfermedad, lo cual se explicó multifactorialmente por la edad, evolución de la enfermedad, carga parasitaria en PBMC, área interna de la lesión, área externa de la lesión, carga parasitaria en frotis/biopsia y número de lesiones. Se determinó que la especie más abundante y por tanto más relacionada con cargas parasitarias elevadas y a considerar es L. braziliensis. Se advierte, entonces, la importancia de identificar molecularmente la especie ante el pronóstico y elección de tratamiento del paciente, así como la importancia de establecer un seguimiento y control médico para estos 23 pacientes, con el fin de prevenir una reactivación de LC o tratar a tiempo una LMC, lo anterior enmarcado en el compromiso de los autores con los pacientes participantes en este estudio.














