Introducción
El término espasticidad se deriva del griego spasticos (δπαδτικσζ) y spaon (δπασν), que quiere decir tirar hacia uno mismo, haciendo referencia a las contracturas musculares presentadas (1). Aunque Hipócrates ya usaba la palabra espasmo para describir un ataque epiléptico, la espasticidad se ha utilizado solo en la literatura más reciente. Good et al. (citados en 2) lo usaron por primera vez en inglés en 1829, describiendo “cuello espástico” (del inglés spastic wryneck), como el exceso de actividad muscular en el lado contraído. Hacia finales del siglo XIX e inicios del siglo XX, las investigaciones de sir Charles Scott Sherrington sobre las posturas de descerebración en gatos mostraron los posibles orígenes de este fenómeno (3,4). Años más tarde, y después de amplias investigaciones, se pudieron determinar con claridad las vías neurofisiológicas que explican la espasticidad, y dentro de estas el auge de la neurocirugía hizo posible el nacimiento de la neurocirugía funcional, como la rama cuyo objetivo es corregir los trastornos funcionales que no pueden normalizarse mediante la cura directa de la lesión causante.
La espasticidad es la secuela neurológica más frecuente, que afecta de manera muy significativa la calidad de vida. Fue definida, por primera vez, en 1980 como un incremento intrínseco de la resistencia muscular dependiente de la velocidad del reflejo tónico de estiramiento al movimiento pasivo de una extremidad en personas con síndrome de motoneurona superior (5,6). Esta definición fue refinada posteriormente como un trastorno del control sensorial y motor que resulta de una lesión de la motoneurona superior y se presenta con activación involuntaria, intermitente y sostenida, de los músculos (7). Esta última definición tiene en cuenta las propiedades viscoelásticas de los tejidos blandos en la rigidez de las extremidades.
En relación con la epidemiología, esta es variable y depende de la etiología que genera el síndrome de motoneurona superior. Esta patología afecta aproximadamente el 35 % de personas con ataque cerebrovascular (ACV), más del 90 % con parálisis cerebral, el 50 % de pacientes con trauma craneoencefálico, el 40 %-80 % de pacientes con trauma raquimedular y entre un 37 %-78 % de los pacientes con esclerosis múltiple (8,9,10,11,12). Este artículo es una revisión narrativa y actualizada sobre la historia, la epidemiología, la fisiopatología y el abordaje diagnóstico y terapéutico de la espasticidad, tanto en la población adulta como en la pediátrica.
Fisiopatología
En cuanto a las bases neurofisiológicas, la espasticidad corresponde a una exageración del reflejo miotático asociado a un fenómeno de hiperexcitabilidad espinal que resulta en una pérdida del control inhibitorio de las vías descendentes supraespinales (13), sobre todo de la vía reticuloespinal (8,9,14,15). Además, se han descrito otras vías relacionadas con la generación de espasticidad, como la conexión monosináptica Ia y II, la vía polisináptica excitatoria Ia, la inhibición recíproca Ia, la inhibición Ib, la inhibición recurrente por las células de Renshaw, la hiperexcitabilidad de las motoneuronas α y γ en el cuerno anterior de la médula espinal por pérdida del control inhibitorio suprasegmentario (6,9,16,17,18,19) (figuras 1 y 2).
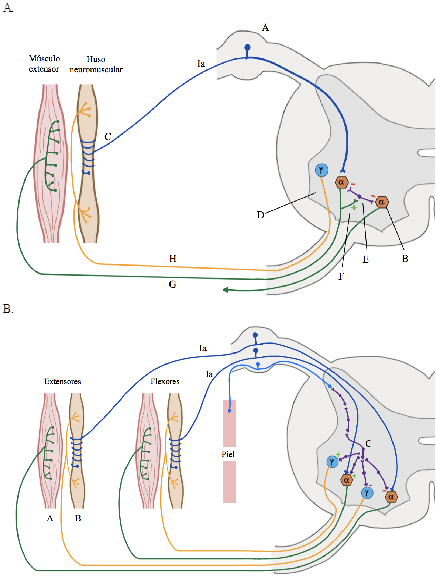
Figura 1 A) Reflejo miotático. A: ganglio de la raíz dorsal. B: Motoneurona α extensora de un músculo sinérgico. C: Terminación primaria. D: Asta anterior de la médula espinal. E: Interneurona de Renshaw. F: Rama colateral recurrente. G: Fibra α. H: Fibra γ. +: sinapsis colinérgica. −: sinápsis gabaérgica. El receptor del reflejo monosináptico es la terminación primaria, la cual es sensible al estiramiento. Ese estímulo percibido es transmitido a la médula a través de fibras Ia de conducción rápida. Entran en contacto con la motoneurona α correspondiente con el músculo estimulado. La motoneurona γ inerva la parte contráctil del huso neuromuscular convirtiéndose en un mecanismo de control periférico del reflejo monosináptico. B) Reflejo polisináptico. A: Músculo. B: Huso neuromuscular. C: Interneuronas. El reflejo polisináptico nociceptivo inhibe las motoneuronas α y γ de los músculos extensores y excita los músculos flexores antagonistas responsables del reflejo en flexión.

Figura 2. Circuito de inhibición Ib Las fibras Ib contactas las interneuronas Ib (IN Ib) inhibitorias (en A) o excitadoras (en B). Las primeras modulan la actividad de la motoneurona α del músculo de donde proviene la fibra y del músculo agonista. Las segundas modulan la actividad de las motoneuronas α que inervan los músculos antagonistas.
La espasticidad es uno de los síntomas del síndrome de motoneurona superior, por lo que es el resultado de lesiones proximales a la motoneurona inferior, es decir, en la médula espinal o el cerebro (8,9,14). La espasticidad puede ser secundaria a múltiples condiciones clínicas, como el ACV, la parálisis cerebral, el trauma craneoencefálico, el trauma raquimedular, la esclerosis múltiple y otras enfermedades neurodegenerativas del sistema nervioso central (8,9,10,14). Cabe resaltar que hay diferencias clínicas según la etiología de la espasticidad, por ejemplo, posterior a un ACV predomina el exceso de tono en músculos flexores de extremidades superiores y hay menos espasmos musculares (9); mientras que, posterior a lesiones medulares, hay espasmos musculares excesivos en extremidades inferiores por contracturas de músculos extensores (9).
En relación con la historia natural de la espasticidad, esta evoluciona en cuatro fases. La fase espástica corresponde a la fase inicial, donde hay un aumento del tono, secundario a un aumento del reflejo miotático; a esta la sigue una fase de actitud vigorosa, secundaria a un desequilibrio muscular donde predominan los músculos flexores y aductores. La tercera corresponde a la fase de retracción muscular, donde hay un crecimiento desigual en función y tamaño de los músculos agonistas y antagonistas. La última fase se caracteriza por la presencia de deformidades osteoarticulares, que son el resultado del fracaso en el tratamiento de las fases previas. Teniendo en cuenta lo anterior, es claro que los pacientes no consultan específicamente por espasticidad, sino por la rigidez, deformidad, dolor y limitaciones funcionales que esta implica (14,20).
Evaluación diagnóstica
Evaluación clínica
Al abordar a un paciente con espasticidad, es importante hacerlo de forma integral. Lo primero es construir una historia clínica completa y descartar la presencia de un factor irritante que exacerbe la espasticidad, por ejemplo, infección urinaria, urolitiasis, úlceras por presión, alteraciones del hábito intestinal, entre otros, ya que estos se deben tratar antes (8,14). También es necesaria una evaluación clínica de forma sistemática, con algunas diferencias entre un paciente adulto y uno pediátrico, valorando todos los aspectos que permitan un enfoque terapéutico dirigido e individualizado. Luego, se indaga por los antecedentes del paciente, incluyendo los perinatales y exposicionales; así como sobre relaciones causales con el inicio de la espasticidad (14). Adicionalmente, se determinan los tratamientos recibidos y la relación entre la aparición de la espasticidad y la lesión de motoneurona superior; si apareció inmediatamente o años después (21).
Posteriormente, se hace un examen físico completo, clasificando a los pacientes en aquellos que tienen la capacidad de deambular (en quienes se debe evaluar los tipos de marcha) y aquellos que no pueden deambular (22). Después se evalúa la postura fisiológica del paciente, los rangos de movimiento activo y pasivo, las extremidades superiores (hombro, codo mano o dedos con espasticidad) y los miembros inferiores (cadera, rodilla, pie o dedos con espasticidad) (8,14,23). Ello para determinar la presencia de retracciones, contracturas, deformidades fijas y espasticidad, clasificando esta última en nefasta o útil (11,21). Como parte del examen neurológico, se evalúa la sensibilidad en todas sus modalidades y la motricidad, haciendo un esquema muscular de la fuerza, el tono y el trofismo por cada segmento muscular. Es fundamental verificar qué segmento muscular espástico es el que más le incomoda al paciente y en qué aspectos afecta su calidad de vida. Para evaluar la funcionalidad y las actividades básicas diarias del paciente con espasticidad, se sugiere el uso de la Escala de Barthel (24).
Escalas diagnósticas
Después de la evaluación clínica del paciente, es indispensable objetivar la espasticidad por medio de escalas. Algunas cuantifican la espasticidad, como las escalas de Ashworth (25) y de Tardieu (26), y otras cuantifican la capacidad funcional, como la Escala de Oswestry (27), la Escala de Discapacidad Funcional Global de la Universidad de Lyon, el Inventario de Evaluación Pediátrica de Discapacidad (PEDI) y el grado de discapacidad con la medida de función gruesa en niños (8,16,28,29). Por otro lado, la Escala de Penn (30) evalúa la frecuencia y evocación de los espasmos y la Escala de Barry-Albright Dystonia evalúa la distonía (8,16,31). Para objetivar la espasticidad se recomienda utilizar las escalas de Ashworth, Penn y una escala funcional. Es importante tener en cuenta que en un paciente pediátrico con parálisis cerebral, la espasticidad no puede ser diagnosticada hasta no cumplir al menos dos años de edad. Se sugiere esperar la maduración del sistema nervioso central y el desarrollo de capacidades funcionales en este grupo etario previo al diagnóstico de esta patología (8).
Estudios adicionales
Una vez finalizada la evaluación clínica integral de la espasticidad, son útiles estudios adicionales para determinar el grado de afectación o de lesión del paciente. Dentro de estos, se pueden utilizar estudios dinámicos de laboratorio de marcha, estudios neurofisiológicos que evalúen el reflejo H, el reflejo T y la inhibición Ib (16,22,29). Además, en pacientes con noxas craneales, cerebrales o espinales es útil la solicitud de neuroimágenes como la resonancia magnética cerebral (32). De importancia, en pacientes con trauma raquimedular, cuya espasticidad empeora o aparece de forma secundaria, es fundamental descartar la presencia de quistes siringomiélicos o inestabilidad espinal con mielopatía imagenológica asociada. De igual forma, si este paciente presenta inestabilidad, se deben tomar imágenes para descartar la presencia de mielopatía.
Tratamiento
Un aspecto fundamental en el manejo de esta patología es que la espasticidad no debe tratarse solo por estar presente, sino cuando es perjudicial o dañina. Por otro lado, el manejo multidisciplinario es clave para lograr los mejores resultados para el paciente y su familia (10). De esta manera, no solo incluye a los especialistas en neurocirugía, sino también en neurología, pediatras con subespecialidades, terapeutas, fisiatras, grupo de enfermería, nutrición, entre otros (9,14). En este orden de ideas, el manejo deberá siempre ser temprano, individualizado y en función de los objetivos específicos del paciente, quien, luego, será valorado en una junta multidisciplinaria (8).
El objetivo global del tratamiento en pacientes con espasticidad es reducir el exceso de esta para evitar la aparición de deformidades y reducir las limitaciones funcionales secundarias (20,33,34). El abordaje terapéutico cuenta con diferentes pilares: manejo no farmacológico, farmacológico, neuroquirúrgico y ortopédico (11).
Manejo no farmacológico
El acompañamiento del médico fisiatra y terapeutas es fundamental, puesto que ningún tipo de manejo funciona sin la presencia de fisioterapia. El manejo no farmacológico incluye terapias posturales, crioterapia, electroestimulación, hidroterapia, fortalecimiento de músculos antagonistas y cinesterapia (9,35). Esta última corresponde a la movilización de articulaciones, estiramiento muscular y facilitación neuromuscular, es decir, facilitación del movimiento voluntario por medio de diferentes técnicas (36). Otra alternativa es el manejo con férulas y ortesis, a efectos de disminuir las deformidades y las limitaciones funcionales (28). Cabe resaltar que el manejo ortopédico es especialmente útil en los pacientes con parálisis cerebral.
Manejo farmacológico
Debido a los efectos adversos sistémicos de los fármacos orales antiespasmódicos, usualmente se utilizan en pacientes con espasticidad difusa (10), de forma individual o combinados para obtener el efecto deseado. Su principal efecto adverso es la supresión general de la actividad neuronal en pacientes que ya tienen disminución de los movimientos voluntarios (9,16).
Baclofeno. Este medicamento constituye el manejo de primera línea para el tratamiento oral de esta patología; de igual manera, puede usarse de forma intratecal. Es un agonista de los receptores GABA-B, que actúan hiperpolarizando las neuronas centrales, en la zona del asta posterior, e inhibe las vías monosinápticas extensoras y polisinápticas flexoras (14,28,37). Se recomienda iniciarlo a una dosis de 10 mg cada 8 horas, y aumentarlo gradualmente 5-10 mg cada 3, 4 o 7 días, hasta alcanzar una dosis máxima de 100 mg por día (8). Tiene una dosis media recomendada de 1,2 mg/kg por día vía oral, y tiene una vida media de 3,5-4 h. Uno de los efectos secundarios más importantes es su sedación, y dado su metabolismo hepático, es preciso vigilar la función hepática con laboratorios periódicos (23). En caso de que no haya respuesta a las 6 semanas, se debe suspender gradualmente, ya que una suspensión abrupta resulta deletérea para el paciente y puede ocasionar la aparición de convulsiones.
Tizanidina. Es un fármaco derivado de la imidazolina, que actúa como un agonista α-2 adrenérgico, al disminuir la actividad refleja polisináptica y, por ende, la espasticidad (14,28). Se debe iniciar a dosis de 2 mg en la noche y se va aumentando en 2 mg cada 2, 4 o 7 días hasta lograr efecto deseado, o en caso de que aparezcan efectos secundarios (38). Dado que es medicamento, tiene una vida media corta de aproximadamente 2,5 h, se debe dar entre 3 y 4 veces al día y hasta una dosis máxima de 36 mg al día (8,28). Al igual que el baclofeno, tiene un metabolismo hepático y, por ende, se deben realizar exámenes paraclínicos de control. Asimismo, puede asociarse con hipotensión, por su efecto α-adrenérgico y también puede causar somnolencia excesiva.
Dantroleno. Este medicamento se deriva de la hidantoína, actúa disminuyendo la cantidad de calcio que se encuentra dentro del retículo sarcoplasmático en las fibras musculares extra e intrafusales y, por ende, confiere un efecto relajante muscular (28,37). Se recomienda una dosis de inicio de 25 mg al día, la cual debe aumentarse cada 4-7 días hasta alcanzar una dosis máxima de 400 mg al día (8,14). Es importante hacer seguimiento de la función hepática, dado el riesgo de hepatotoxicidad (38). El dantroleno es uno de los medicamentos de elección en pacientes con espasticidad secundaria a trauma craneoencefálico y ataques cerebrovasculares isquémicos, ya que tiene una mejor respuesta.
Benzodiacepinas. Dentro de este grupo farmacológico, el diazepam y el clonazepam son los medicamentos de elección para el manejo de la espasticidad por medio de una reducción del estímulo del reflejo polisináptico, por su acción en los receptores GABA-A (28). Del diazepam se recomienda una dosis de hasta 30 mg al día dividida en 3 o 4 dosis. Estos fármacos también son útiles en el tratamiento de espasmos nocturnos y es importante tener en cuenta que pueden afectar la recuperación neurológica del paciente (8,38).
Antineuropáticos. Incluyen medicamentos como la gabapentina y la pregabalina, que pueden cruzar la barrera hematoencefálica. Actúan sobre el receptor GABA y modulan la regulación de calcio intracelular (10,14,28). En relación con su dosis, la gabapentina se debe iniciar con 75-100 mg al día e incrementar su administración a 3 veces al día para una dosis máxima de 3600 mg (14). Dentro de sus efectos secundarios están la somnolencia y el mareo; por esto, no se recomienda en personas jóvenes y activas que tengan una actividad laboral demandante (38).
Cannabinoides. Son particularmente útiles en el tratamiento de espasticidad secundaria a esclerosis múltiple, puesto que suelen requerir altas dosis de las opciones terapéuticas ya mencionadas y la respuesta a estos puede ser limitada. Incluyen el tetrahidrocannabinol y el cannabidiol, que actúan como agonistas de receptores de cannabinoides específicos como el CB1, porque producen analgesia, relajación muscular y efecto ansiolítico. En modelos animales se ha descrito su utilidad en el manejo de la espasticidad secundaria a esclerosis múltiple y lesión medular (39).
Otros. Algunos de los medicamentos utilizados de segunda o tercera línea o de forma coadyuvante a los de primera línea que ya fueron mencionados son la clonidina y la ciproheptadina (10).
Manejo neuroquirúrgico
El manejo neuroquirúrgico debe individualizarse de acuerdo con la clínica, la distribución topográfica de la espasticidad y la funcionalidad de cada paciente. De igual manera, este debe adaptarse a la realidad de nuestro país. Antes de discutir las alternativas disponibles, se deben tener en cuenta las siguientes premisas. Se recomienda que, previo a llevar a los pacientes a este tipo de manejo, tengan una evolución clínica de aproximadamente un año donde se hayan utilizado las alternativas terapéuticas no quirúrgicas y el manejo conservador ya planteado. Asimismo, se debe eliminar la presencia de cualquier factor que esté exacerbando la espasticidad como infecciones, siringomielia, tumores, seudoartrosis, alteraciones gastrointestinales, entre otras (8,14). Por último, es obligatorio definir los riesgos y complicaciones de cada procedimiento, así como los beneficios y su impacto sobre la calidad de vida del paciente, sus cuidadores y familia. Estos beneficios varían según la funcionalidad previa del paciente y severidad de su espasticidad; incluyendo mejoría del dolor, disminución de posiciones anómalas, facilidad para la movilidad y aseo, etc.
Es importante tener en cuenta que las intervenciones neuroquirúrgicas preceden a la cirugía ortopédica, porque al reducir la espasticidad excesiva, se pueden lograr mejores resultados. No hay una indicación exacta o absoluta sobre el momento apropiado para considerar el tratamiento neuroquirúrgico; sin embargo, este se recomienda cuando el exceso de espasticidad es dañino per se, es decir, antes de que las contracturas y anquilosis articulares sean severas y aparezcan deformidades irreductibles (40). Esta decisión es aún más controversial en la población pediátrica; no obstante, se sugiere que la decisión no sea basada en la edad, sino en otros factores más importantes como el deterioro del desarrollo del niño. Este último puede cuantificarse de forma objetiva por medio de las escalas ya mencionadas, especialmente por la de función motora gruesa (8,16).
Los métodos quirúrgicos para la reducción de la espasticidad se clasifican de dos maneras según sus efectos: la duración y su extensión. En cuanto a la duración, pueden ser permanentes o temporales (reversibles o transitorios), y en cuanto a su extensión, pueden ser focales o generales. Dentro de los tratamientos focales están las inyecciones con toxina botulínica (efecto temporal) y la fasciculotomía funcional selectiva (efecto permanente). En contraparte, dentro de las opciones con efectos generales, está la infusión de medicación intratecal como una medida temporal, y la drezotomía y rizotomía posterior como medidas permanentes (figura 3).
De igual manera, se debe clasificar la espasticidad de acuerdo con su extensión en: segmentaria, regional o generalizada. Para la segmentaria, está indicada la fasciculotomía funcional selectiva; para la regional, la drezotomía en adultos o la rizotomía dorsal funcional selectiva en niños, y para la generalizada, el baclofeno intratecal (figura 4).
Una vez se ha hecho el diagnóstico definitivo de espasticidad y hay indicación de manejo neuroquirúrgico se deben cumplir ciertas condiciones por parte del paciente y su familia para poder realizarlo: potencial de mejoría con la intervención, realismo de la familia o cuidadores frente a los objetivos del procedimiento y adecuada red de apoyo. Si estas condiciones no se cumplen, el paciente se reorienta a un manejo farmacológico, no farmacológico y debe ser valorado por ortopedia para definir la necesidad de tenotomías, miotomías, artroplastias u osteomías (11,41). Es importante tener en cuenta que el pronóstico de los pacientes con espasticidad es variable y depende de su severidad, así como de las limitaciones funcionales del paciente, la etiología del síndrome de motoneurona superior y la respuesta individual a los diferentes tipos de manejo.
Alternativas terapéuticas con efectos focales
Toxina botulínica. Esta toxina es producida por Clostridium botulinum y también es utilizada en otras patologías neurológicas. Actúa al unirse a sitios de alta afinidad a nivel presináptico en las terminales nerviosas colinérgicas; de esta manera, disminuye la liberación de acetilcolina y genera un efecto de bloqueo en la unión neuromuscular que produce una quimiodenervación transitoria (14,42,43,44). Está indicada para espasticidad focal de extremidades y como medida prequirúrgica para evaluar la utilidad de realizar una neurotomía periférica (45,46). Su efecto es temporal y dura aproximadamente de tres a cuatro meses; además, a diferencia de los fármacos orales, tiene menor incidencia de efectos adversos sistémicos (14,47). La dosis varía dependiendo del tamaño del músculo hacia el cual se dirige la toxina, y el serotipo más utilizado es el A (28,34). La inyección de esta toxina debe realizarse por medio de métodos palpatorios, electromiográficos o bajo guía ecográfica.
Fenolización. El fenol actúa como anestésico local por medio del bloqueo de las fibras γ, que ocasionan una axonotmesis química sin lesión de los tubos endoneurales. De esta manera, se altera la conducción nerviosa y se interrumpe el arco relejo, que resulta en una disminución del tono muscular (48). La técnica puede dirigirse a diferentes puntos: inyección perineural cercana del tronco nervioso, bloqueo cercano de la rama motora, bloqueos abiertos del punto motor y bloqueo intramuscular del punto motor (14,48,49).
La fenolización se utiliza frecuentemente durante la fase de recuperación de una lesión de motoneurona superior para disminuir la espasticidad durante ese momento y mejorar el rango de movimiento, prevenir contracturas y permitir la reeducación de patrones motores. Su utilidad es mayor en lesiones posteriores a trauma craneoencefálico y trauma raquimedular, que en pacientes con ACV (48). De igual manera, puede utilizarse cuando no hay mejoría de la espasticidad con manejo farmacológico oral; sobre todo en pacientes funcionales que pueden realizar ciertas actividades con la extremidad espástica y en pacientes que son incapaces de utilizar la extremidad afectada. En estos últimos, hay un requerimiento de neurólisis más extensa (48).
Fasciculotomía funcional selectiva. Este procedimiento está indicado en casos de espasticidad segmentaria o focal de músculos o grupos musculares por medio de la sección de uno o pocos nervios accesibles a un abordaje quirúrgico. Por ejemplo, el nervio tibial posterior en el pie espástico, el nervio obturador en la cadera espástica, el nervio ciático en la rodilla espástica, los nervios mediano y cubital para una muñeca espástica con deformidad, entre otros. Se recomienda que sea lo más cercano posible al músculo, con el fin de cortar las ramas específicas motoras, y seccionar no más de 4/5 del nervio, es decir, preservar al menos el 25 % de las fibras motoras para no abolir completamente el tono, mantener fuerza residual y evitar problemas distróficos.
Alternativas terapéuticas con efectos generales
Bomba de baclofeno intratecal. Este tratamiento consiste en neuromodulación por medio de la liberación de baclofeno intratecal, dado por una bomba de infusión programable localizada a nivel subcutáneo abdominal (50,51). En contraste con la administración oral de este medicamento, la administración intratecal se relaciona con mayor efectividad en el control de la espasticidad y menor sedación del paciente (8,51,52). Está indicada para pacientes con para o tetraparesias o plejías que tengan espasticidad difusa severa, espasticidad de origen medular espinal (espasmos dolorosos en pacientes con esclerosis múltiple avanzada), diplejía espástica en niños con parálisis cerebral y pacientes hemipléjicos secundarios a un ACV (53,54). Esta modalidad terapéutica es ideal en pacientes quienes requieren la espasticidad para poder mantener una postura erguida y el equilibrio durante la locomoción, porque al graduar el efecto del baclofeno podría recuperarse la marcha y tener mayor recuperación funcional. Por el contrario, presenta contraindicación relativa en pacientes con falla renal, mujeres embarazadas o con lactancia materna, historia clínica de crisis no controladas, trastornos psiquiátricos o psicóticos (14,32).
Antes de la implementación definitiva, se requiere una fase de prueba, que consiste en poner un catéter intratecal y hospitalizar 8 días al paciente, para cada día aplicar un bolo de baclofeno de 25-50-75-100 µg. Posteriormente, se evalúa la respuesta mediante la Escala de Ashworth (52). Se considera una respuesta positiva si no hay pérdida de la función y si hay una disminución de 2 puntos en la escala (tabla 1). En caso de que no haya una respuesta positiva, se puede repetir un bolo con un incremento de 25-50 µg, hasta máximo un total de 100 µg. No se debe administrar más de un bolo en un periodo de 24 h (52).
Tabla 1 Escala de Ashworth modificada adaptada de 7
| Puntaje | Descripción |
| 0 | No hay cambios en la respuesta del músculo en los movimientos de flexión o extensión. |
| 1 | Ligero aumento en la respuesta del músculo al movimiento (flexión o extensión) visible con la palpación o relajación, o solo mínima resistencia al final del arco de movimiento. |
| 1+ | Ligero aumento en la resistencia del músculo al movimiento en flexión o extensión seguido de una mínima resistencia en todo el resto del arco de movimiento (menos de la mitad). |
| 2 | Notable incremento en la resistencia del músculo durante la mayor parte del arco de movimiento articular, pero la articulación se mueve fácilmente. |
| 3 | Marcado incremento en la resistencia del músculo, el movimiento pasivo es difícil en la flexión o extensión. |
| 4 | Las partes afectadas están rígidas en flexión o extensión cuando se mueven pasivamente. |
Los pacientes con respuesta positiva son candidatos a una fase definitiva, la cual se realiza en salas de cirugía, donde se ubica al paciente en decúbito lateral derecho, se coloca el catéter en el espacio L3-L4 o L4-L5 y se avanza hasta la región dorsal media o alta (T6 a T8). La altura depende de si se abarcan los miembros inferiores solamente o también los superiores, según la afectación de la espasticidad (52). La dosis inicial de la bomba intratecal se calcula como el doble a la cual el paciente presentó una respuesta clínica positiva, y se titula con un incremento del 10 %-20 % hasta lograr la mejoría de espasticidad deseada. Teniendo en cuenta la cinética del baclofeno intratecal, se recomienda una infusión continua, aunque existen diferentes esquemas que deben adaptarse a cada paciente (55). Cuando desee retirarse, se debe dar baclofeno y una benzodiacepina oral para disminuir el síndrome de abstinencia y mejorar el control de la espasticidad. Se ha estudiado el uso de otros medicamentos para infusión intratecal como el fenol y la clonidina; sin embargo, no se utilizan con frecuencia, debido a los buenos resultados y tolerancia obtenidos con el baclofeno (9).
Drezotomía. A diferencia de la infusión intratecal de baclofeno, la drezotomía tiene un efecto permanente. Se encuentra indicada para la espasticidad difusa de miembros inferiores, para o tetraparesia o plejía con hipertonía y dolor, hemiplejía con espasmos dolorosos en flexión, espasticidad difusa de miembros superiores con posturas anormales y dolor, y para la vejiga espástica neurogénica (40,56,57).
Esta técnica fue descrita en 1972 por el Dr. Marc Sindou. Consiste en seccionar las fibras laterales de la zona de entrada de la raíz dorsal (reflejo miotático Ia y fibras nociceptivas) y mantener las fibras mediales o lemniscales (56,58). Después de abrir el surco dorsolateral ventrolateralmente a la entrada de las raicillas, a una angulación de 35º a nivel cervical y 45º a nivel lumbar, se realiza microcoagulación con una profundidad de 3 mm para el control del dolor, 4-5 mm para control de la espasticidad y 5-6 mm para control de la distonía (56,58).
Rizotomía dorsal funcional selectiva. Al igual que la drezotomía, la rizotomía se considera un procedimiento permanente. Tiene indicaciones muy puntuales dentro de las cuales están pacientes pediátricos con parálisis cerebral del subtipo de diplejía espástica o cuadriplejía (59), pacientes deambulantes o con alguna movilidad independiente sin o con mínimas características distónicas (60), pacientes con afectación de miembros superiores o debilidad troncal y adultos menores que tienen una diplejía espástica relativamente leve y pueden caminar de forma independiente (59,60,61). Hay múltiples variaciones en relación con la técnica, comportamiento neurofisiológico y porcentaje de rizotomía; perose recomienda utilizar el monitoreo intraoperatorio, seccionando la respuesta 3+ y 4+ de los criterios de Park (62,63,64). En cuanto a la rizotomía, se recomienda no seccionar >75 % de las raicillas sensoriales a cualquier nivel, >50 % de las raicillas dorsales de L4 y >50 % de ambas raíces de S2 dorsales (65). Aunque se ha descrito el uso de la rizotomía por radiofrecuencia, sus efectos son temporales y esta no ha sido ampliamente estudiada (61).
Otros. Dentro de otros métodos quirúrgicos, está la mielotomía longitudinal propuesta por Bischof, que busca una separación entre el cuerno anterior y posterior lumbosacro. Está indicada en casos de paraplejías con espasmos en flexión, ausencia de control motor residual útil y ausencia de función vesical y sexual (32). Cabe mencionar también los procedimientos de neuromodulación, como la estimulación cortical y la estimulación de cordones posteriores (16,28,66). Esta última es útil para el manejo complementario de trastornos de la continencia urinaria y fecal. Por último, es necesario mencionar que posterior a la realización de procedimientos neuroquirúrgicos y cuando se presentan deformidades osteoarticulares, se podría plantear el uso de cirugías ortopédicas como las miotomías, las tenotomías y las osteotomías (41,67).
Conclusiones
La espasticidad es una patología compleja que se encuentra asociada a muchas otras patologías neurológicas y tiene un gran impacto en la calidad de vida de los pacientes y sus familias. Además, solo requiere una alta sospecha clínica y un examen neurológico completo para poder hacer su diagnóstico. Por otro lado, es fundamental una gran colaboración entre especialistas para orientar los esfuerzos terapéuticos según la necesidad de cada paciente, y de esta manera impactar positivamente en su calidad de vida y la de su familia.

















