Introducción
El retinoblastoma (Rb) constituye el tumor ocular más frecuente en la población pediátrica. Corresponde al 3 % de todas las neoplasias malignas de la infancia, con una incidencia anual de 1/20.000 nacimientos. Generalmente, afecta a niños muy pequeños: dos tercios de los casos se diagnostican antes de los 2 años de edad, y más del 90 %, antes de los 5 años (1,2). El Rb fue descrito por primera vez como una patología intrínseca de la retina por el cirujano James Wardrop, en 1809, y el término fue acuñado en 1922 por Frederick Verhoeff (1).
El Rb tiene dos formas clínicas, unilateral o bilateral, aunque algunos textos describen también el retinoblastoma trilateral cuando se asocia con lesiones pineales. El Rb unilateral (unifocal) es el más común y corresponde aproximadamente al 75 % de los casos. En un 90 % es no hereditaria y en un 10 % de los casos es de línea germinal (2). En cambio, el Rb bilateral (multifocal) es una forma hereditaria que se presenta en aproximadamente el 25 % de todos los pacientes (3). Esta se desarrolla a partir de una mutación en la línea germinal por la inactivación del antioncogen RB1, localizado en el cromosoma 13 en la región q14.2 por mutaciones como deleciones, translocaciones, inserciones, mutaciones puntuales e incluso modificaciones epigenéticas. Lo anterior lleva a la pérdida de la fosfoproteína nuclear, un regulador esencial del ciclo celular, que provoca la diferenciación defectuosa de los retinoblastos (4,5). Cabe resaltar que en el 25 % de los casos, esta mutación se hereda de un padre afectado, y resulta de una mutación de novo en el útero en el 75 % de los casos.
La sospecha comienza con el examen clínico, en el cual se detalla la presencia de leucocoria (aparición de un reflejo o mancha blanca en la región pupilar) y estrabismo (desviación ocular), en el 50 % y el 20 % de los pacientes, respectivamente (4-7). De ahí que se deban realizar estudios imagenológicos para determinar la extensión de la lesión y si la enfermedad se encuentra intra o extraocular (2,8). Dentro de los diagnósticos diferenciales están la enfermedad de Coats, la catarata congénita, el desprendimiento de la retina, la toxocoriasis u otras patologías que puedan cursar con estrabismo (4,9).
Respecto a la clasificación del Rb, dentro de la literatura podemos encontrar varias, sin embargo, la Clasificación Internacional para Retinoblastoma (ICRB) es la más utilizada en las diferentes series publicadas en el ámbito internacional. Esta clasificación nos ayuda a estadificar y a determinar el mejor tratamiento local o sistémico, según grupos A, B, C, D o E, donde el estadio A es el de mejor pronóstico y el E es el de peor pronóstico (9-11).
El abordaje terapéutico de pacientes con Rb siempre debe ser individualizado, teniendo en cuenta el potencial de preservar la visión, estadio de la enfermedad a nivel ocular y extraocular y si la afectación es unilateral o bilateral (9,12,13). Los principales objetivos son obtener la mayor supervivencia y la preservación de la visión dentro de lo posible (9,12-14). Las opciones de tratamiento incluyen cirugía (enucleación); quimioterapia (QMT), que puede administrarse de forma sistémica, intrarterial o intravítrea (15-17); terapias focales, con crioterapia, fotocoagulación con láser y termoterapia transpupilar (18-20), y radioterapia (RDT), mediante braquiterapia y radioterapia por haz externo (21).
Según la ICRB, en los pacientes del grupo A, la principal alternativa son las modalidades focales; mientras que el uso de QMT y RDT se ve restringido a pacientes con enfermedad progresiva (9,12,14). En el caso del grupo B, se utiliza la QMT en conjunto con el tratamiento focal. En pacientes del grupo C o D se utilizan regímenes más intensivos de QMT, terapias focales y se debe considerar la RDT en casos de siembras vítreas masivas posteriores a terminar la QMT. En pacientes del grupo E se debe realizar la enucleación primaria, es decir, como primera alternativa de manejo para evitar la diseminación al sistema nervioso central o aparición de metástasis (9,12,14). Otra alternativa de gran utilidad en el manejo del Rb es la quimioterapia intrarterial (QIA), que se discute más adelante.
En pacientes con enfermedad extraocular orbitaria o locorregional debe darse QMT prequirúrgica, seguida de resección de masas orbitarias residuales y posterior adyuvancia con RDT y QMT adicional (13). En contraparte, en pacientes con diseminación al sistema nervioso central, los resultados son poco favorables y el manejo puede incluir administración de QMT sistémica e intratecal, así como radiación cráneo-espinal (22). Los desenlaces son similares en pacientes con enfermedad metastásica y las alternativas de manejo incluyen esquemas de altas dosis de QMT ablativa para la médula ósea con posterior trasplante autólogo (13).
Quimioterapia intrarterial
La QMT puede administrarse por varias rutas, como la intravenosa, la periocular, la intravítrea o la intrarterial. La estrategia depende principalmente de la gravedad del tumor ocular, estadificado con la clasificación ICRB (23). La QIA para el retinoblastoma es una modalidad terapéutica que permite la administración directa de agentes quimioterapéuticos a patologías malignas intraoculares por vía de la arteria oftálmica. Esta alternativa surgió como una estrategia para mejorar los desenlaces y el salvamento ocular en pacientes con Rb clasificados en los grupos D y E, ya que no es buena su respuesta a la QMT sistémica. Este tratamiento está diseñado para salvar vidas y preservar la visión y, por lo tanto, necesita ser individualizado. Los factores que deben considerarse incluyen la unilateralidad o bilateralidad de la enfermedad, el potencial para preservar la visión y la estadificación intraocular y extraocular (9). La QIA es efectiva como tratamiento primario en el 72 % de los casos, y como tratamiento secundario (después de la quimioterapia intravenosa o el fracaso de otros métodos de tratamiento) en el 62 % (24).
Indicaciones
La QIA está indicada como método de tratamiento efectivo con eficacia comprobada para lograr el control del tumor en la enfermedad unilateral, incluso en pacientes con enfermedad avanzada (grupos D y E) que hubieran sido manejados con enucleación. Es decir, ahora se pueden manejar con estrategias de preservación del globo ocular, utilizando QMT intravenosa combinada con QIA. De hecho, la principal razón del fracaso de la QIA y la enucleación subsecuente es la recurrencia de semillas subretinianas o vítreas (25-27). Las indicaciones de QIA para pacientes con Rb son:
Rb unilateral (incluso grupo D y E, según la ICRB).
Rb de mutación no germinal.
Edad mayor de 3-4 meses.
Peso mayor 6 kg.
Rb recurrente después de una QIV previa o radioterapia con placa.
Semillas subretinianas recurrentes que involucran dos o más cuadrantes.
Semillas vítreas recurrentes.
Tumores sólidos.
Ventajas y desventajas
Frente a otros tipos de tratamiento, la QIA presenta ciertas ventajas como (25,28):
Reducción de las complicaciones sistémicas de la QMT, como neutropenia, anemia, infección, neoplasias secundarias, ototoxicidad o neurotoxicidad.
Menor necesidad de hospitalización, lo que permite que el niño sea dado de alta el mismo día, en ausencia de complicaciones vasculares intraoperatorias.
En relación con la quimiorreducción sistémica, tiene la capacidad de administrar dosis significativamente más altas (10 veces) de QMT directamente al lecho tumoral y las metástasis, lo que puede aumentar el efecto biológico, mejorar el control del tumor y reducir la tasa de recurrencia.
En contraparte, algunas de las desventajas asociadas con este tipo de intervención incluyen (23,29):
Es menos efectivo para los pacientes con Rb avanzado del grupo E y para los tumores con siembra vítrea (tasa de recurrencia más alta).
Riesgo de lesión endotelial y trombosis de arteria oftálmica, que requieren el uso de rutas alternativas, lo que conlleva un desafío técnico y está limitado por el riesgo de eventos isquémicos y tromboembólicos.
Riesgo adicional asociado por la exposición a la radiación ionizante durante la fluoroscopia.
Técnica
La QIA para el Rb fue descrita por primera vez en 1954 por Reese et al. (30), quienes realizaron una instilación directa de QMT en la arteria carótida interna ipsilateral al ojo afectado. Más tarde, un grupo de investigadores japoneses liderados por Makoto Mohri (31) modificaron la técnica, al cateterizar la arteria carótida interna desde un punto de acceso femoral, ocluyendo su flujo distal con un balón y administrando después la QMT en el punto de ramificación de la arteria oftálmica (figura 1). Abramson et al. (32) describieron la canulación selectiva de la porción proximal de la arteria oftálmica bajo guía fluoroscópica para administración focal de QMT.
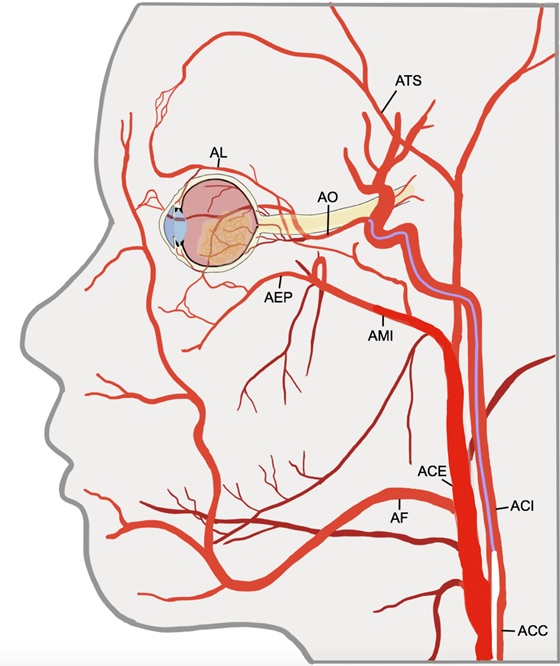
Figura 1. Técnica para la infusión selectiva de quimioterapia intrarterial en la arteria oftálmica con oclusión temporal de arteria carótida externa con balón. Se posiciona un catéter diagnóstico de 4 French (blanco) en la arteria carótida interna en su porción cervical y se posiciona un microcatéter coaxial en la arteria oftálmica (azul). Un balón de oclusión de doble lumen (verde) con una microguía coaxial se posiciona y se infla en la arteria carótida externa. La caída de presión en la arteria carótida externa secundaria a la oclusión temporal con balón promueve un flujo anterógrado en la arteria oftálmica.ACC: arteria carótida común, ACE: arteria carótida externa, ACI: arteria carótida interna, AEP: arteria esfenopalatina, AF: arteria facial, AL: arteria lacrimal, AMI: arteria maxilar interna, AO: arteria oftálmica, ATS: arteria temporal superior.
Se realiza el paso a paso del procedimiento quirúrgico para la QIA descrito por diferentes autores (25,26,31,33-35)
Paso a paso:
Se realiza inducción y anestesia general.
El abordaje transfemoral continuará siendo la primera opción para niños pequeños y bebés debido a limitaciones en el calibre arterial.
Colocación del introductor femoral bajo guía ecográfica, entre 4-5 French (Fr).
La heparina se administra con un tiempo de coagulación activado entre 200 y 300 segundos.
Por el introductor femoral se navega un catéter guía 5 Fr hasta la porción distal de la arteria carótida común y a través de él se avanza un microcatéter Magic 1.5 Fr soportado en microguía Hybrid 0,008 hasta alojarlo en el ostium de la arteria oftálmica (AO) que se va a tratar. La tasa de éxito técnico en manos expertas es tan alta como 98 % a 100 %, aunque en el 16 % de los pacientes se requiere una vía vascular alternativa.
Si el último enfoque no tiene éxito, el cateterismo de la AO se puede realizar alternativamente a través de la rama orbital de la arteria meníngea media cuando esta está bien desarrollada.
Esto es seguido por una inyección superselectiva para confirmar la posición del microcatéter y determinar ausencia o no de reflujo en la arteria carótida interna.
Los agentes quimioterapéuticos, diluidos en 30 ml de solución salina, se administran de forma pulsátil durante 30 minutos para garantizar la administración homogénea del fármaco.
La mayoría de los pacientes recibieron sesiones trimestrales.
Melfalán a dosis de 3, 5, o 7,5 mg dependiendo del peso corporal del paciente.
El melfalán es muy tóxico a niveles terapéuticos cuando se usa sistémicamente, pero se puede usar de manera segura por vía intrarterial.
Se cree que el riesgo de resistencia al melfalán intrarterial en los Rb recurrentes es mínimo
Se agrega topotecán de una dosis de 1 mg si hay una siembra vítrea extensa.
El niño es observado de cerca y dado de alta el mismo día en ausencia de complicaciones.
Se administra aspirina oral (40 mg/día) durante 2 semanas.
Como en cualquier procedimiento neurovascular en la población pediátrica, la QIA se ha hecho tradicionalmente a través de un acceso transfemoral. Varios estudios, particularmente en cardiología intervencionista, han mostrado una reducción en las complicaciones del sitio de punción y la mortalidad del procedimiento, una disminución de la estadía, una reducción de los costos hospitalarios y una mayor satisfacción del paciente con la ruta transradial (36). Este acceso puede ser particularmente útil en la población pediátrica, ya que el acceso femoral conlleva un mayor riesgo de hemorragia en relación al menor volumen de sanfre que tienen estos pacientes (25). Desde el punto de vista técnico, el acceso radial se diferencia del femoral, en que el introductor usado es 4 Fr y una vez el acceso ha sido establecido se administra un cóctel de 500 unidades de heparina, 1 mg de nicardipina y 50 µg de nitroglicerina por vía intrarterial (25).
Quimioterapia
El mefalán es el principal agente quimioterapéutico utilizado en QIA, dada su eficacia y su corta vida media (1,5 horas), lo que lo convierte en un candidato ideal para la inyección local. Aunque el melfalán se ha mantenido como el agente más utilizado y eficaz utilizado intrarterialmente, se puede combinar con topotecán o carboplatino cuando las respuestas son subóptimas o la enfermedad intraocular está muy avanzada (semillas vítreas extensas). La eficacia del carboplatino contra el Rb se ha documentado en la QMT sistémica. Sin embargo, este agente se usa de forma limitada en la QIA, por sus efectos esclerosantes en la vasculatura oftálmica. Por esto, se reserva para tumores bilaterales para reducir la dosis acumulada de melfalán o para casos en los que el tratamiento con melfalán más topotecán no fue exitoso (37).
Las dosis de los agentes quimioterapéuticos están determinadas por la edad, el volumen ocular y por la anatomía angiográfica. En la literatura se ha descrito que producen un efecto antitumoral significativo y una toxicidad limitada con 2,7-7,5 mg para melfalán, 0,3-1 mg para topotecán y 25-50 mg para carboplatino. Los pacientes generalmente reciben de 1 a 6 (3 en promedio) administraciones intrarteriales de quimioterapia, en monoterapia con melfalán, o en combinación con otros agentes, y las respuestas generalmente se observan inmediatamente después de la primera administración (9,24,37-39).
Tasa de enucleación y supervivencia ocular
Para los pacientes con Rb sin tratamiento previo, la supervivencia ocular sin radiación de 2 años es del 80 % al 90 % (9,37-39), y para aquellos con Rb unilateral, con el uso de QIA se pueden lograr tasas de recuperación ocular mayores al 70 % (37,40). Peterson et al. (41), en su experiencia con 17 ojos tratados, reportaron una reducción de la tasa de enucleación del 100 % al 23,5 % con el uso de QIA. De igual manera, Shields et al. (15) encontraron que el manejo primario con QIA para lograr con éxito el salvamento del globo ocular fue del 100 % para el grupo C y D, y del 33 % de los ojos del grupo E. Por el contrario, la recuperación del globo ocular se logró con éxito en el 50 % de los casos en que el QIA era un tratamiento secundario. Estos hallazgos fueron consistentes con otros estudios, donde las tasas de recuperación ocular para pacientes con enfermedad recurrente o progresiva fueron consistentemente más bajas, con tasas de supervivencia global del 50 % al 60 % (42). Gobin et al. (37) encontraron que la QIA fue bien tolerada y efectiva para el Rb con recuperación del globo ocular a los 2 años en un 82 % si la QIA era el tratamiento primario y del 58 % si era un tratamiento secundario. Thampi et al. (43), con hallazgos similares, observaron una tasa de respuesta del 86 % en los grupos A, B y C, pero solo una respuesta del 38 % en los grupos D y E. De este modo, en publicaciones subsecuentes, el grupo de Shields observó en su experiencia de 5 años unas tasas de recuperación del globo ocular del 100 % para los ojos del grupo B y C, del 94 % para los ojos del grupo D y del 36 % para el grupo E ojos. Además, de los 70 ojos, se logró una regresión completa para el tumor sólido en 48 de 51 ojos (94 %), semillas subretinianas en 40 de 42 ojos (95 %) y semillas vítreas en 34 de 39 ojos (87 %) (24).
En un estudio que correlacionó la edad y la supervivencia, la mortalidad relacionada con el retinoblastoma para pacientes jóvenes (0-1 años) fue del 4,6 %, para pacientes de edad intermedia (1-2 años) fue del 8,9 %, para los pacientes de más edad (2-7 años) fue del 19 % y para los pacientes de más edad (7 años) fue del 2 % (44,45). De esta manera, las tasas de curación para pacientes con Rb son tan altas como el 96 % en Estados Unidos, pero la carga de la enfermedad sigue siendo significativa para países en vías de desarrollo, donde las tasas de mortalidad pueden alcanzar el 39 % y el 70 % en países en vías de desarrollo y países desarrollados, respectivamente (33).
La enfermedad metastásica corresponde solo al 3,6 % (46) y para aquellos pacientes manejados con QIA esta llega a ser solo del 1,6 % (47).
Complicaciones
Las complicaciones asociadas con el procedimiento de QIA no superan el 6 % (24,26,48-50). Las descritas, entre el 4 % y el 6 %, son: atrofia del epitelio pigmentario de la retina, atrofia coroidea, oclusión de la arteria oftálmica, edema transitorio del párpado y blefaroptosis. Dentro de las complicaciones con tasas de entre el 2 % y el 3 % se encuentran: isquemia macular, hemorragia vítrea, espasmo de la arteria oftálmica con reperfusión, isquemia coroidea parcial, hemorragia vítrea, hiperemia en la frente. Finalmente, aquellas descritas en el 1 % incluyen: atenuación de la vasculatura retiniana, amputación retiniana periférica, oclusión de ramas de la arteria retiniana, hemorragia subretiniana, palidez del disco óptico y neuropatía óptica. No debe olvidarse que un riesgo adicional asociado con la QIA es la exposición a la radiación ionizante durante la fluoroscopia. En manos experimentadas, el tiempo medio de fluoroscopia por procedimiento es de 7 minutos, con dosis de radiación por procedimiento que pueden ser tan altas como 191 mGy para el ojo afectado y de 35 mGy para el ojo contralateral. Aunque, el centro más experimentado ha informado de dosis tan bajas como 1 mGy por procedimiento, después de múltiples procedimientos, las dosis acumuladas pueden alcanzar de 0,1 a 0,2 Gy, que pueden ser cataratogénicas y potencialmente cancerígenas en esta población susceptible.
Costos
Respecto al ámbito de costoefectividad, las estrategias de tratamiento de menor a mayor costo por episodio de atención son: la enucleación, seguida de la terapia focal con láser, la QMT sistémica sola, la QMT sistémica con enucleación planificada y, por último, QIA con melfalán, la cual aumenta su costo para casos bilaterales (51). González et al. (52) presentaron la experiencia de 8 años de un centro en Colombia en el manejo de Rb con QIA y evidenciaron que al contar con una institución especializada y un equipo multidisciplinario, es posible alcanzar tasas de sobrevida y salvamento ocular similares a aquellas encontradas en países de mayor nivel socioeconómico.
Conclusiones
Aunque la enucleación es más rentable, debe utilizarse como último recurso, dado el riesgo de una posible enfermedad contralateral y el problema de dejar al paciente con visión monocular. La enucleación disminuye la agudeza visual (falta de suma binocular) y el campo visual, perjudica la orientación espacial y la percepción de profundidad y tiene efectos psicológicos en el niño. Si bien la enucleación es menos favorecida en los países con mayor desarrollo socioeconómico, todavía se utiliza ampliamente en los países en vía de desarrollo, donde los niños no tienen acceso a centros terciarios sofisticados (51).















