Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.19 no.1 Bogotá Jan./Mar. 2004
(1) Sección Cirugía de Seno, Fundación Santa Fe de Bogotá. Bogotá, Colombia.
(2) Departamento de Radiología, Fundación Santa Fe de Bogotá. Bogotá, Colombia.
(3) Departamento de Medicina Nuclear, Fundación Santa Fe de Bogotá. Bogotá, Colombia.
(4) Interna Cirugía de Seno, Fundación Santa Fe de Bogotá. Bogotá, Colombia.
Correspondencia: Fabio Torres Franco, Jefe Sección Cirugía de Seno, Calle 116 No 9-02, Bogotá, D.C., Colombia. clinica.seno@fundacionsantafe.com
Fecha de recibo: Septiembre 2 de 2003. Fecha de aprobación: Febrero 20 de 2004.
Resumen
Las lesiones mamarias ocultas o no palpables son clínicamente descubiertas como hallazgos incidentales durante una mamografía de tamizaje. Su localización prequirúrgica es indispensable. Este trabajo muestra la experiencia en la Fundación Santa Fe de Bogotá con un nuevo método desarrollado inicialmente en Milán que consiste en la localización de lesiones mamarias no palpables mediante la inyección de una pequeña cantidad de tecnecio 99 lavado con albúmina coloidal, el cual es inoculado dentro de la lesión bajo guía estereotáxica o ecográfica. La correcta ubicación del inóculo se comprueba mediante una gammagrafía. Con el uso de una sonda que capta rayos gamma (neoprobe 2000) se localiza el sitio de la lesión y posteriormente se procede con la remoción quirúrgica de la misma.
El uso de esta técnica facilita resecar de una manera rápida y precisa las lesiones mamarias no palpables, reduce el volumen de tejido mamario resecado, permite centrar mejor las lesiones y da libertad al cirujano para realizar incisiones con resultados finales más estéticos.
Palabras clave: hiperplasia ductal atípica, tumores no palpables del seno, microcalcificaciones.
Abstract
Occult or nonpalpable breast lesions are discovered as incidental finding in screening mammography. Its preoperative localization is imperative. This paper reports the experience at the University Hospital of Fundación Santafe de Bogotá with a new method originally developed in Milan consisting in the localization of nonpalpable lesions by the injection of a small volume of technecium 99 labelled colloidal albumin into the lesions under stereotactic or echograpenic guidance. The correct localization of the innoculum is confirmed by gammagraphy. The site of the lession is determined using a gamma probe (Neoprobe 2000), and the surgical resection can them be carried out.
The use of this technique facilitates the surgical resection of non palpable lesions, wich can be done with precision and accuracy, reducing the volumen of tissue that must be resected,and giving the surgeon the opportunity to perform the operation with better cosmetic results.
Key words: atypical ductal hyperpalsia, nonpalpable breast tumors, microcalcifications.
Introducción
Los tumores no invasivos constituyen un pequeño porcentaje (1-5%) de los cánceres mamarios diagnosticados. El uso de la mamografía como medio de detección precoz de cáncer ha incrementado el número de lesiones preinvasivas. Las publicaciones actuales muestran que 15-25% de los cánceres de seno son carcinomas intraductales y que muchos de éstos son clínicamente no palpables (2-3).
La localización prequirúrgica de las lesiones no palpables es indispensable (11), aun cuando sabemos que ninguno de los métodos actuales puede ser catalogado como ideal (7, 10-16). Un nuevo método para la localización radioguiada de lesiones ocultas (ROLL - Radioguided occult lesion localization) (4), se desarrolló inicialmente en Milán y en nuestra institución lo hemos adaptado con algunas variaciones y con resultados similares.
Materiales y métodos
Entre el 21 de enero y el 11 de agosto de 2003, 15 pacientes fueron llevadas a biopsia excisional usando la técnica ROLL para lesiones no palpables, las cuales fueron localizadas mediante mamografía cuando existían microcalcificaciones agrupadas o distorsiones del parénquima, y bajo guía ecográfica para nódulos mamarios sospechosos y/o distorsiones.
Localización radioguiada de las lesiones
El mismo día de la cirugía las pacientes fueron inyectadas intratumoralmente con partículas de albúmina sérica humana 0,5 mg en 0,2 ml de SSN (diámetro de las partículas 10-150um) lavada con 0.1mCi (3-7MBq) de tecnecio 99.
En nuestro caso, una vez inoculado el macroagregado con el Tc99, a los 15 minutos se toman dos proyecciones gammagráficas del seno (GE-Star Camm 4000) (tiempo de exposición tres minutos) para comprobar la radiactividad del material inyectado. Dentro de la misma jeringa que contiene el TC99+macroagregado se mezcla una mínima cantidad (0,2 ml) de un medio de contraste hidrosoluble (Conrayd) que sirve para comparar y verificar la correcta localización de la lesión, mediante la toma de una imagen mamográfica (dos proyecciones), en la cual las microcalcificaciones quedan cubiertas por el medio de contraste (figura 1) para luego proceder a la resección guiados por una sonda hand-held que detecta rayos gamma (neoprobe 2000).
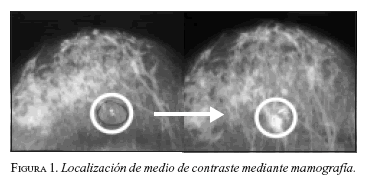
Cuando la lesión se localiza mediante ecografía, se comprueba la correcta localización de la misma, evidenciando un cambio de la ecogenicidad del sitio de la lesión.
La gammasonda, que se cubre con un dedo de guante estéril, capta los rayos y los traduce en una cantidad numérica y una señal acústica. La intensidad y la frecuencia de las señales son directamente proporcionales al nivel de radiactividad detectado. Posteriormente el radiólogo marca sobre la piel con un punto el sitio más perpendicular y el trayecto más corto a la lesión (el cual corresponde al sitio de mayor radiactividad), lo cual facilita al cirujano realizar una incisión más libre y con mejor resultado estético.
Una vez resecado el espécimen se controla que no haya radiactividad en el lecho tumoral; si está presente, se procede a ampliar el área que tiene radiactividad residual.
Con respecto al estudio del ganglio centinela, en aquellas pacientes con diagnóstico previo de carcinoma mamario se inyectaron el mismo día de la cirugía 0,2 ml de albúmina marcada con tecnecio 99 por vía subdérmica. Dos horas después se tomaron dos proyecciones gammagráficas (anterior y oblicua anterior), en las cuales se evidenció el ganglio centinela (12).
Una vez identificado, y a través de una incisión axilar de menos de 2 cm, se procedió a tomar biopsia del ganglio centinela con la ayuda del neoprobe. El ganglio resecado fue enviado a patología para biopsia por congelación. En los casos en los cuales la biopsia fue negativa, no se realizó disección axilar.
Se usó la misma incisión para la biopsia del ganglio centinela (12) en los casos en los cuales el tumor se encontraba en los cuadrantes superiores, y diferente incisión en aquellos cuyo tumor estaba en los cuadrantes inferiores.
Análisis de los especímenes
El espécimen quirúrgico resecado es orientado por medio de clips metálicos en por lo menos dos de sus márgenes. Para verificar la remoción completa de la lesión, el espécimen es colocado en una bandeja plástica con el margen profundo hacia abajo y posteriormente radiografiado.
La concentricidad de las lesiones se calculó como la diferencia de las distancias máxima y mínima desde el centro de la lesión hasta al margen del espécimen. La distancia máxima desde la lesión al margen del espécimen fue valorada como índice de cantidad de tejido resecado.
Resultados
La localización de las lesiones se realizó bajo guía estereotáxica en siete pacientes y bajo guía ecográfica en las ocho pacientes restantes (tabla 1).

Con la técnica ROLL la media de la distancia máxima desde el centro de la lesión al margen fue de 13,7 mm con una desviación estándar de 0,3 mm (rango entre 5 y 25 mm). La media de la concentricidad (diferencia entre la máxima y la mínima distancia desde el borde de la lesión al margen del espécimen) fue de 3,2 mm (0,2) con rango entre 1 y 10 mm (tabla 2).

Las lesiones fueron agrupadas según la clasificación histológica de tumores de seno de la Organización Mundial de la Salud, modificada por Rosen y Oberman (5).
El 47% de las lesiones resecadas fueron tumores malignos, de los cuales el 27% correspondieron a carcinomas in situ y el 20% a carcinomas ductales infiltrantes. Dentro de las lesiones benignas el 33% fueron hiperplasias ductales atípicas. Estas pacientes tenían biopsia previa con el mismo diagnóstico de hiperplasia ductal atípica, por lo cual fueron llevadas a cirugía para resección completa de la lesión (tabla 3).

La biopsia por congelación del ganglio centinela se realizó en cinco pacientes, entre las cuales en dos fue reportada como positiva para la presencia de metástasis; por ello estas pacientes fueron sometidas a disección axilar completa de los tres niveles de Berg. Los tratamientos realizados se muestran en la tabla 4.

La inyección de albúmina en una paciente causó un ligero malestar local, pero no se observaron reacciones adversas.
En 14 de 15 pacientes, el área radiactiva coincidió con la lesión tanto en la localización cutánea como en la del parénquima mamario. En una paciente la inyección del inóculo quedó a 2 cm por encima de la lesión, lo cual obligó a hacer una escisión más amplia; posteriormente se realizó una mamografía al espécimen y se comprobó la completa inclusión de la lesión dentro del espécimen.
Una paciente presentó contaminación en el trayecto de la inoculación, por lo cual tuvimos que hacer una inyección más tarde. Este incidente se superó con la técnica de la burbuja de aire al final de la jeringa, evitando así que al retirar la jeringa se deje un trayecto desde el sitio de inyección a la piel.
Dosimetría
La dosis media absorbida en el área del inóculo se estima en 0,03 (0,02) mGy/MBq; dicho inóculo queda concentrado en el tejido resecado.
La dosis absorbida por las manos del cirujano se evaluó en 7,5 (5,0) uSv/h. Si en un año se tratan 100 pacientes la dosis absorbida por el cirujano correspondería a 1,5 (1,0%) y a 0,2 (0,1%) de la dosis límite recomendada para la población general (50mSv/ano) y para trabajadores expuestos (500mSv/ano), respectivamente (6).
Discusión
Se han desarrollado muchas técnicas para la localización preoperatoria de lesiones mamarias no palpables, algunas ya en desuso. La elección de la técnica depende de las características de la lesión, especialmente del sitio (superficiales o profundas) y del equipo disponible (6-10,13,14).
El método más común son los arpones (11,14) (Kopans, Homer), los cuales requieren la introducción de una aguja guía que es traumática y en muchas ocasiones, cuando la aguja no es posicionada correctamente y se intenta reposicionar, es causa de sangrado. Algunos arpones que no quedan fijos se movilizan dentro del tejido mamario, se rompen y son causa de neumotórax. Igualmente, en senos muy densos el proceso de localización se hace más dificultoso.
Existen otros métodos como la localización con carbón, la localización cutánea que por su imprecisión y mayor cantidad de tejido mamario resecado han caído en desuso.
Como con todas las técnicas de localización, se debe que tener mucho cuidado en los primeros procedimientos. En nuestros casos el radiotrazador fue posicionado correctamente en el 92%.
Sabemos además que es un método seguro tanto para el personal médico y paramédico, ya que con esa mínima cantidad de material radiactivo utilizada, la dosis absorbida es menor del 2% de lo recomendado para la población general (5).
Una gran ventaja es que el sitio exacto donde se localizó la lesión puede ser controlado varias veces por el cirujano durante la operación, usando la sonda (neo-probe) y así planear la mejor incisión independiente del sitio de inoculación.
Además, en algunos casos fue tan preciso que no requirió la ampliación de los márgenes de la lesión, es decir, logró ser diagnóstico y terapéutico.
La técnica aquí descrita forma parte de los procedimientos mínimamente invasores en cáncer de seno, la cual puede ser complementada con la administración de radioterapia intraoperatoria (PBI) (15,16) y de esta manera ofrecer en un solo acto operatorio parte del tratamiento adyuvante que estas pacientes requieren.
Conclusiones
El uso de gamma probe permite resecar de una manera rápida y precisa las lesiones mamarias no palpables. Al comparar nuestros resultados con los publicados mediante el método de los arpones, esta técnica radioguiada reduce el volumen de tejido mamario resecado, permite centrar mejor las lesiones y da libertad al cirujano para realizar incisiones con resultados finales más estéticos.
Referencias
1. Page DL. Japaze. Patology of malignat lesions. Non infiltrating (in situ) carcinoma. WB Saunders 1991; 169-192. [ Links ]
2. Goedde TA, Fryberg ER. The impact of mammography on breast biopsy. Am Surg 1992; 58: 661-666. [ Links ]
3. Tubiana M, Holland R, Kopans DB, Petit JY. Commission of the ESO advisory report. Management of non palpable and small lesions found in mass breast screening. Eur J Cancer 1994; 30A: 538-547. [ Links ]
4. Zurrida S, Galimberti V, Monti S. Radioguided localization of occult breast lesions. Breast 1998; 7: 11-13. [ Links ]
5. Rosen PP, Oberman HA. Atlas or tumor pathology. Tumor of the mammary gland. 3rd series fascicle 7. Washington DC, Armed Forces Institute of Pathology, 1992. [ Links ]
6. International Commission on Radiological Protection. Publication 60. Oxford, Pergamon Press 1991. [ Links ]
7. Hermann G, Janus G, et al. Percutaneous localization of non palpable breast lesions demonstrated by mammography Breast 1983; 9: 4-6. [ Links ]
8. Framk HA, Hall FM, et al. Preoperative localization of non palpable breast lesions demonstrated by mammography. N Engl Med 1976; 295: 259-260. [ Links ]
9. De Kopans DB, Luca S. A modified needle-hookwire technique to simplify preoperative localization of occult breast lesions. Radiology 1980; 134: 781. [ Links ]
10. Homer MJ. Non palpable lesion localization using a curved-end retractable wire. Radiology 1985; 157: 259-260. [ Links ]
11. Sánchez H, Cambas A. Imágenes diagnósticas en cáncer de seno. En: Hernando Abaúnza O (ed). Cáncer mamario. Segunda edición. Bogotá. Sociedad Colombiana de Cirugía 1997; 79-108. [ Links ]
12. Lee G, Wilke and Armando Giuliano. Sentinel limph node biopsy in patients with early breast cancer. Status of national trials. Surg Clin North Am 2003; 83: 901. [ Links ]
13. Lisa A, Newman and Tara A. Washington. New trends in breast conservation therapy. Surg Clin North Am 2003; 83: 841. [ Links ]
14. González MA. Diagnóstico de lesiones no palpables de seno. Rev Colomb Cir 2002; 17: 224-231. [ Links ]
15. Vicini F, Kini VR, Chen P, et al. Irradiation of the tumor bed alone ataer lumpectomy in select patients with early breast cancer treated with breast conserving therapy. J Surg Oncol 1999; 70: 33-40. [ Links ]
16. Orecchia R, Ivaldi G, Ghilezan, et al. Intraoperative radiotherapy (IORT) in conservatively treated breast cancer. Radiother Oncol 2000; 56: 142. [ Links ]














