Introducción
Las duplicaciones del tracto gastrointestinal son anormalidades congénitas poco frecuentes que pueden afectar cualquier porción del tubo digestivo, desde la boca hasta el ano y tienen una incidencia global de 1 por cada 4500-10.000 nacidos vivos 1,2. Las duplicaciones gástricas, representan solo el 4 % de esta patología. La mayoría se diagnostican en los primeros meses de vida y en la población adulta es poco usual encontrarlas, generalmente como hallazgo incidental en estudios imagenológicos. En los adultos habitualmente no hay síntomas y su tratamiento es controversial. Cuando presentan infección, hematemesis y obstrucción por compresión de estructuras vecinas, la resección quirúrgica es el tratamiento de elección 3. El objetivo de este artículo fue presentar el caso de un adulto con esta patología, tratado exitosamente mediante cirugía.
Caso clínico
Paciente femenina de 26 años, quien consultó por epigastralgia recurrente a pesar de múltiples tratamientos farmacológicos, por lo cual fue direccionada al servicio de gastroenterología donde, entre otros estudios, se le realizó una endoscopia de vías digestivas altas, en la que identificaron una lesión subepitelial de 25 mm con mucosa normal, localizada en la cara anterior del cuerpo proximal, a la cual se le tomó biopsias (Figura 1).
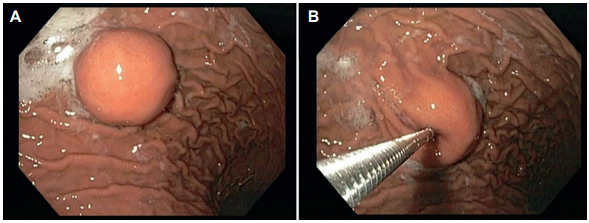
Figura 1. A: visión endoscópica del quiste de duplicación gástrica. B: toma de biopsia de la lesión.
Posteriormente, para garantizar una mejor caracterización de la lesión, se realizó una ultrasonografía endoscópica, que reportó la presencia de una lesión subepitelial bilobulada, de predominio hipoecoica, bien delimitada y homogénea, sin contenido quístico y aparentemente dependiente de la muscular propia, de 36 x 22 mm, sugestiva de neoplasia estromal gastrointestinal (GIST, por sus siglas en inglés), a la cual se le realizó una punción guiada por ecoendoscopia para nueva toma de biopsia (Figura 2). Ante esta sospecha diagnóstica, se ordenó una tomografía computarizada (TC) contrastada de abdomen, con el fin de estadificar la lesión, con hallazgo de una lesión exofítica de tejidos blandos, de 34 x 35 mm, localizada en la curvatura mayor, que sobrepasaba la pared gástrica, sugestivas de GIST, sin evidencia de compromiso metastásico asociado.
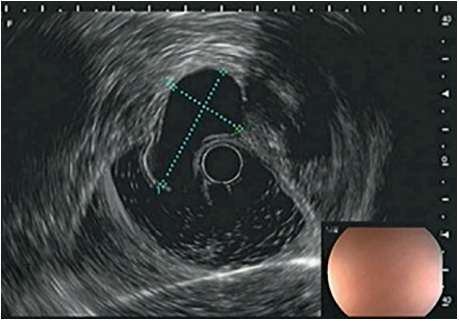
Figura 2. Visión eco-endoscópica de lesión bilobulada subepitelial con contenido quístico, dependiente de la muscular propia.
En el estudio histopatológico se encontró una población fusocelular, con alta sospecha de tumor estromal gastrointestinal, por lo que la paciente fue remitida al servicio de Cirugía general. Ante la sospecha diagnostica de GIST gástrico sin una confirmación histológica, se le planteó a la paciente la realización de una gastrectomía vertical laparoscópica, asistida por endoscopia intraoperatoria, para garantizar la resección completa de la lesión y realizar un estudio histológico definitivo de la misma.
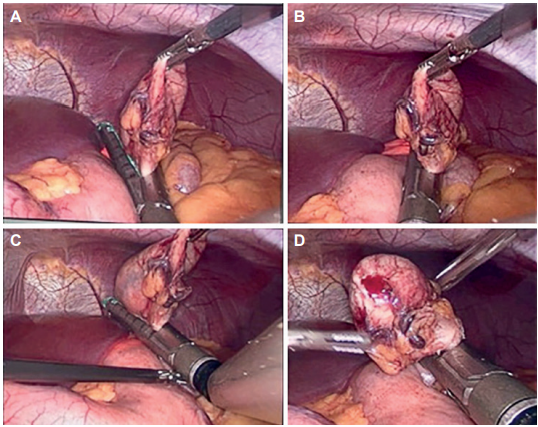
El procedimiento quirúrgico se llevó a cabo completamente laparoscópico (Figura 3), y mediante la inspección completa de la cavidad abdominal se pudo descartar la presencia de alteraciones adicionales. Una vez localizada la lesión, se realizó la endoscopia intraoperatoria para visualizar la masa en la cavidad gástrica, y se procedió a la gastrectomía vertical con una grapadora lineal cortante en múltiples tomas, verificando la resección completa de la lesión mediante la endoscopia y preservando la mayor cantidad posible de tejido sano. Una vez terminada la resección de la lesión, se revisó la cámara gástrica mediante endoscopia, confirmando la ausencia de lesión residual, estenosis o deformidades, como el estómago en reloj de arena. La pieza quirúrgica fue extraída en una endobolsa mediante la ampliación del puerto umbilical.
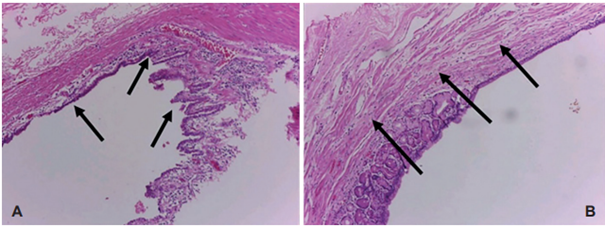
La duración del procedimiento quirúrgico fue de 2,5 horas, no hubo sangrado intraoperatorio ni otras complicaciones. La paciente fue dada de alta al día siguiente, y se realizó control por consulta externa al décimo día, encontrando una buena evolución, con adecuada tolerancia a la ingesta de alimentos y control del dolor postoperatorio. El informe de patología reportó una lesión quística tapizada por mucosa gástrica y capa muscular externa, sin evidencia de malignidad ni displasia, lo cual permitió realizar el diagnostico de quiste de duplicación gástrica (Figura 4).
Discusión
Las duplicaciones gastrointestinales son anomalías congénitas poco frecuentes 4. Desde el primer reporte publicado en 1911 5, se han informado cerca de 150 casos de duplicaciones gástricas 6,7. Su fisiopatogénesis no es del todo clara, planteándose múltiples teorías 8, siendo la de la vacuolización la más aceptada, donde se postula que durante el desarrollo embrionario ocurre una recanalización anormal del tracto digestivo, después de la etapa epitelial sólida, 9. En orden de frecuencia, los órganos más comprometidos son el intestino delgado, el colon, el esófago, el estómago, el duodeno y otros segmentos 10.
En una revisión de 109 duplicaciones gástricas se encontró una edad media del diagnóstico a los tres meses de vida, afectando principalmente a mujeres (63 %), como ocurrió en nuestro caso. Se presentan como lesiones únicas, con un tamaño promedio de 3 a 6 cm. El 50 % se diagnostican antes del primer año de vida y el 70 % antes de los 12 años 11,12.
Son lesiones que típicamente se continúan con la pared gástrica y están rodeadas completamente por tejido muscular liso, que se fusiona con la capa muscular propia gástrica en la porción más externa; en su interior están revestidas por mucosa gástrica, aunque también pueden tener mucosa ectópica proveniente del intestino embrionario anterior (páncreas, intestino delgado, colon y epitelio respiratorio).
Se clasifican en tubulares, si tienen comunicación con la luz gástrica, y quísticas, en el caso contrario; esta última es la presentación más frecuente, en cerca del 80 % de los casos 13. Las duplicaciones intestinales se originan en la parte dorsal del intestino primitivo, por lo que, la mayoría de las veces, se localizan en la curvatura gástrica mayor, pero pueden localizarse en la pared anterior o posterior, cardias y, menos frecuentemente en el píloro y la curvatura menor 14.
En etapas tempranas de la vida, se presenta como una masa abdominal palpable, que puede causar síntomas obstructivos altos. En la edad adulta, generalmente son lesiones asintomáticas que se diagnostican de manera incidental durante la realización de estudios imagenológicos de rutina o endoscopia digestiva alta. Algunos pacientes pueden presentar reflujo gastroesofágico, vómito secundario al efecto de masa, alteraciones en el funcionamiento gástrico, episodios de sangrado digestivo por la ulceración del epitelio, o síntomas inespecíficos como epigastralgia refractaria al manejo 15, que fue el caso de nuestra paciente.
El diagnóstico preoperatorio representa un verdadero reto, ya que, por sus características de lesión mural con líquido proteínico espeso en su interior, puede simular otro tipo de lesiones gastrointestinales como los GIST 16 o la presencia de otras lesiones quísticas de órganos adyacentes como el páncreas, la vía biliar o el bazo 17. En este caso, la lesión fue enfocada como un GIST de manejo quirúrgico, lo que demuestra la dificultad diagnóstica en estos pacientes.
Los estudios imagenológicos tradicionales con bario muestran un defecto quístico intraluminal que emerge hacia afuera de la curvatura mayor. Con la ecografía de abdomen se puede visualizar una lesión hipoecogénica quística en el abdomen superior, adyacente al estómago, páncreas, hígado y vía biliar. La TC contrastada de abdomen y la resonancia magnética nuclear (RMN) permiten determinar la naturaleza quística de la lesión y la relación con las estructuras adyacentes, observándose en ambos casos una lesión redonda o tubular con captación del medio de contraste en las paredes. Estos hallazgos siguen siendo inespecíficos y no se consideran definitivos para el diagnóstico 18,19.
La eco-endoscopia, tiene un papel fundamental en el diagnóstico, al identificar la lesión con una mucosa interna ecogénica y una capa muscular externa hipoecogénica 20. La punción guiada por ecografía es controversial y algunos lo consideran importante para hacer el diagnóstico, al reportar histología típica gástrica, y para descartar malignidad asociada al quiste, sin embargo, la presencia de un informe de patología por punción guiada normal, no excluye la presencia de malignidad 21,22. La medición de marcadores tumorales en el líquido del quiste tampoco parece ser relevante, pues la concentración de CA 19-9 y antígeno carcinoembrionario en el interior del quiste, pueden estar aumentadas de manera fisiológica, sin indicar un compromiso neoplásico 23.
La confirmación definitiva se realiza mediante el análisis histológico que reporta la presencia de un quiste con una capa muscular externa y una capa interna con epitelio de mucosa gástrica o gastrointestinal proveniente del intestino primitivo (pulmón, lengua, hígado, páncreas, intestino delgado o colon), o cualquier tipo de mucosa respiratoria 24. En el caso presentado, el diagnóstico solo se pudo realizar con el resultado histopatológico del espécimen quirúrgico.
El tratamiento de esta patología es controversial. Algunos autores consideran que las duplicaciones gástricas tubulares, independientemente de si son sintomáticas o no, deben ser llevadas a resección quirúrgica por el riesgo de complicaciones asociadas, mientras que, las duplicaciones quísticas asintomáticas, pueden tener un manejo conservador, con seguimiento imagenológico, y solo realizar cirugía en pacientes sintomáticos 25.
La posibilidad de transformación maligna de estas lesiones, que no puede ser descartada mediante biopsias guiadas, ni por la medición de niveles de antígenos tumorales, así como las demás potenciales complicaciones, han llevado a plantear la resección completa de estas lesiones siempre que se diagnostican 26,27. Los quistes de duplicación pueden ser diagnosticados de forma errónea en el preoperatorio y llevadas a cirugía, al ser enfocadas como tumores estromales gastrointestinales, como ocurrió con nuestra paciente.
Idealmente, el abordaje quirúrgico debe realizarse de forma laparoscópica, aunque en la literatura se han documentado pocos casos en adultos, todos con buenos resultados postquirúrgicos 28. Sin embargo, paradójicamente las técnicas laparoscópicas han llevado a la resección de una gran cantidad de tejido circundante sano, con un aumento en la posibilidad de causar deformidades gástricas, que pueden alterar el funcionamiento y vaciamiento gástrico 29.
En los últimos años, las cirugías gástricas laparoscópicas endoasistidas han disminuido el riesgo de deformidades gástricas y resección de tejido sano de manera innecesaria, mediante la visualización endoscópica directa de la lesión 30-32. El caso presentado, es uno de los pocos de cirugía laparoscópica endoasistida que encontramos reportados en la literatura, evidenciando las ventajas de este procedimiento al permitir localizar de manera más exacta la lesión y garantizando la resección completa de la misma. Además, permite preservar mayor cantidad de tejido gástrico sano, con excelentes resultados postquirúrgicos 33.
En algunas ocasiones, pueden presentarse complicaciones asociadas al quiste como perforación, ulceración, formación de fistulas, obstrucción o incluso transformaciones malignas del epitelio del quiste, una complicación rara pero posible. En la literatura se ha reportado por lo menos 15 casos de neoplasias dentro de la duplicación gástrica, siendo el adenocarcinoma a partir del epitelio gástrico del quiste el predominante 34. También se ha encontrado carcinoma escamocelular, GIST y tumores neuroendocrinos dentro de la duplicación gástrica 35,36. El pronóstico de estos tumores es muy pobre, con hallazgo frecuente de metástasis durante el estudio inicial o de forma temprana durante el seguimiento posterior a la resección; en estos casos, la resección quirúrgica continúa siendo el manejo de elección, seguida de la administración de quimioterapia adyuvante 37.
Conclusiones
Las duplicaciones gástricas son un hallazgo infrecuente en pacientes adultos. Su diagnóstico clínico representa un reto y usualmente se confunde con otras patologías, incluyendo los tumores estromales del tracto digestivo. Su tratamiento continúa siendo controvertido en los pacientes asintomáticos, sin embargo, dado el riesgo de complicaciones asociadas, incluida la transformación maligna, varios autores proponen la resección quirúrgica como el manejo de elección en todos los pacientes. Las resecciones laparoscópicas se consideran la vía de elección y el uso de endoscopia intraoperatoria permite, de manera eficaz, garantizar la resección completa de la lesión, preservando la mayor cantidad de tejido sano adyacente y previniendo estenosis o deformidades gástricas que afecten su adecuado funcionamiento.