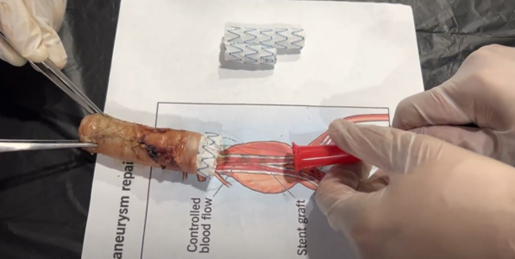
Introducción
Después del tratamiento endovascular del aneurisma de aorta abdominal (AAA), la conversión se define por la necesidad de realizar cirugía por vía abierta, con el retiro parcial o total del endoinjerto, y algunos lo consideran un fracaso del abordaje endovascular inicial 1. La indicación de la conversión y la explantación puede ser urgente o electiva, precoz inmediata (cuando se realiza perioperatoria), precoz (durante los primeros 30 días) o tardía (posterior a este límite de tiempo), o puede ser una conversión secundaria (cuando se realiza en otra intervención posterior) 2,3.
La conversión precoz es generada por errores técnicos en la planificación del procedimiento endovascular, la elección de la prótesis, problemas de acceso (rotura arterial o del aneurisma de aorta abdominal), problemas en la navegación de las guías y los catéteres a través de la luz de las arterias y el AAA, despliegue, trombosis o colapso del endoinjerto o alguna de sus ramas, por imposibilidad de canalizar alguna de las ramas ilíacas, desconexión de la endoprótesis, migración aguda, por endofuga tipo I proximal o distal primaria de gran flujo, o por la oclusión de una o ambas arterias renales durante el procedimiento. La infección de la endoprótesis, la rotura aórtica por endofuga persistente o migración y la aparición de fístula aorto-entérica (FAE) son las causas más habituales de la conversión tardía y la necesidad de explantación de la endoprótesis aórtica 1-3.
Algunas de estas complicaciones pueden resolverse con técnicas endovasculares, sin embargo, cuando está indicada, la explantación de una endoprótesis aórtica conlleva una alta morbimortalidad, ya que es un procedimiento complejo que se asocia a lesiones vasculares o viscerales, en pacientes con edad avanzada y múltiples comorbilidades, con un alto riesgo quirúrgico. Además, no hay disponibles dispositivos producidos por la industria con el fin de explantar las endoprótesis aórticas 1,2,4. Por lo tanto, el objetivo de este trabajo fue desarrollar un dispositivo para la explantación de endoprótesis aórticas, con el fin de hacerlo de forma segura, fácil y con bajo costo.
Métodos
Se llevó a cabo un estudio experimental preclínico, en el que se diseñó y se probó en un modelo ex vivo porcino y 3D, el explantador de Cabrera, un dispositivo para extraer endoprótesis aórticas, que busca limitar la lesión de la pared aórtica al momento de la explantación de la endoprótesis y hacer menos mórbido este procedimiento.
El mecanismo del explantador de Cabrera consiste en realizar una tracción sostenida y estable de los cables con la mano derecha y con la mano izquierda llevar de forma progresiva de distal a proximal el embudo hasta colapsar la endoprótesis e ir ingresando el embudo a través de la luz aórtica para que sea el embudo el único que se mueve y no se tenga de traccionar ni jalar la endoprótesis, con el fin de evitar el desgarro y lesión de la pared aórtica y el endotelio, liberando de forma controlada los dispositivos de fijación supra en infrarrenal de las endoprótesis, colapsándolos y protegiéndolos al interior del embudo.
Construcción del explantador de Cabrera
Inicialmente se construyó un dispositivo a escala 1x5, utilizando un embudo de policloruro de vinilo (PVC), con una longitud de 6 cm, un diámetro de 5 cm en su extremo máximo y de 8 mm en su extremo mínimo, alambres de cobre recubiertos con látex de 3 mm de grosor y 20 cm de longitud y cinta de soldadura, con el fin de comprobar el mecanismo de funcionamiento y poder identificar sus falencias (Figura 1).
El proceso de construcción de este prototipo inicial se detalla paso a paso en el vídeo anexo (Ver el vídeo en el siguiente enlace https://youtu.be/7bhemFMgYSo?si=BOQWI3udUFBQB_93), el video anexo, en donde podemos observar cómo se ensamblan los 8 alambres de cobre recubiertos con látex con la cinta de soldadura y se acoplan con el embudo de PVC. Luego se le creó a cada alambre sus ganchos de agarre para tener la capacidad de tomar la endoprótesis a explantar y contraerla de forma simétrica y dinámica, con el din de limitar al máximo el daño endotelial y de la pared aórtica.
Posteriormente se verificó que el funcionamiento del explantador de Cabrera fuera factible y seguro, realizando tracción y contratracción del embudo sobre los ganchos y extremidades de fijación, los cuales van sujetos a la endoprótesis aórtica a explantar.
Ya confirmado que el mecanismo de funcionamiento del explantador de Cabrera era efectivo y aplicable, se realizaron dos ensayos simulando una endoprótesis, el primero con un tubo de cartón y el segundo con un tubo de plástico, para probar dos materiales diferentes y a su vez comprobar la resistencia de la estructura del dispositivo. Se pudo ver cómo la estructura del dispositivo era compacta, sólida y resistente, incluso superando al cartón y el plástico, los cuales ante la tracción del explantador de Cabrera se desgarran en los puntos de fijación.
El explantador de Cabrera a escala 1x1 se creó con un embudo de policloruro de vinilo (PVC) con una longitud de 4 cm, un diámetro de 1,5 cm en su extremo máximo y de 8 mm en su extremo mínimo, alambres de cromo, níquel y titanio (Niti) de 0,12 mm de grosor y 20 cm de longitud y cinta de soldadura, como se aprecia en el vídeo (Ver el vídeo en el siguiente enlace https://youtube.com/shorts/ONt93oVfwVQ?si=rJ1Z09vB2k09AH0O) del video. Ocho alambres quirúrgicos de Niti con terminación en forma de gancho se colocaron de forma horaria a través del embudo, para ser fijados en el orificio distal de la endoprótesis, ensamblándolos con la cinta de soldadura y acoplándolos con el embudo de PVC y sus ganchos de agarre, para tener la capacidad de tomar la endoprótesis, con el fin de realizar una tracción uniforme en cada borde, contraerla de forma simétrica y dinámica con el menor esfuerzo mecánico posible.
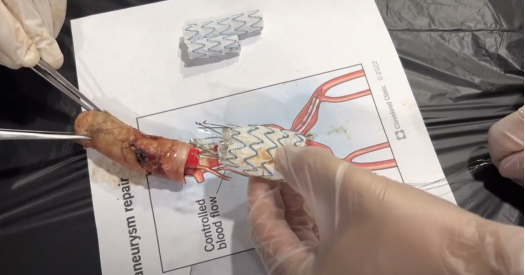
El explantador debe ingresar a través de la aorta, colapsando la endoprótesis en su sitio, sin traccionarla, para evitar desgarrar la pared aórtica, y de esta forma llegar hasta el orificio proximal de la endoprótesis donde se ubican los ganchos de fijación (Figura 2). El explantador, al colapsar el orificio proximal de la endoprótesis aórtica, desacopla los ganchos de fijación de la pared aórtica sin traumatizarla, y de esta forma se completa la explantación, de la manera más atraumática posible, limitando al máximo el daño endotelial y de la pared aórtica (Ver el vídeo en el siguiente enlace https://youtu.be/krEKdFpEeAI?si=AC82keooMKAW8Ji-).
Modelo de experimentación ex vivo
Se usaron modelos de aortas abdominales creadas con impresoras 3D, en las cuales se desplegó una endoprótesis aórtica infrarrenal realizando la extracción de la endoprótesis con el explantador de Cabrera.
Modelo animal de experimentación cadavérico
El estudio se planteó inicialmente con 2 aortas abdominales de cerdos macho, híbridos entre Large White y Landrace, de 8 meses de edad, libres de patógenos específicos, de entre 40 y 70 kg de peso 5,6.
Previa implantación de la endoprótesis aórtica a nivel infrarrenal de la aorta cadavérica porcina, se hizo apertura de la aorta abdominal a nivel infrarrenal, a 5 mm de la bifurcación ilíaca y se identificó la endoprótesis aórtica. Se localizó el orificio distal y se seccionó su parte distal para extraer la bifurcación de la prótesis y las extensiones ilíacas. Se posicionó y probó el explantador de Cabrera. Se extrajo la endoprótesis y se verificó el porcentaje de daño de la pared aórtica.
No se requirió ninguna intervención ni seguimiento postoperatorio al ser un modelo cadavérico animal.
Plan de análisis
Al ser un estudio experimental preclínico, se realizó una descripción completa de todos los hallazgos durante el desarrollo del experimento, identificando y detallando características del dispositivo como: tipo de materiales con los que se construyó el dispositivo, capacidad de agarre a la endoprótesis, capacidad para colapsar la endoprótesis, capacidad para liberar los ganchos de agarre de la endoprótesis de la pared aórtica, daño de la pared aórtica al final de la explantación, duración de la explantación, éxito en la explantación, ergonomía del dispositivo y resistencia de los materiales del dispositivo.
Después de los ensayos, dos miembros del equipo quirúrgico (cirujanos visitantes) recibieron un cuestionario para evaluar el dispositivo. Se les preguntó sobre la facilidad de instalación, la rigidez y resistencia del dispositivo y su impresión del diseño del sistema; también se les pidió que comentaran sobre cualquier complicación que anticiparon durante el uso del dispositivo y que discutieran cualquier cambio o característica adicional que les gustaría ver en el dispositivo, con el fin de establecer la viabilidad y seguridad del uso de este dispositivo.
Resultados
Se probó el explantador de Cabrera a escala 1x1 con una endoprótesis sin fijación suprarrenal y de estructura anillada de níquel titanio (Nitinol), tipo AorfixTM (Lombard, Didcot, Reino Unido). Después de haber enganchado el explantador a la endoprótesis y activar su mecanismo de funcionamiento, se observó cómo se contrae de forma simétrica y colapsa la prótesis sin dificultad, con un agarre firme y sin desgarrar la endoprótesis o perder segmentos de la misma.
Se prosiguió a realizar las pruebas en el modelo 3D y ex vivo utilizando un segmento de aorta infrarrenal de 6 cm de un porcino macho de 70 kg con un diámetro aórtico de 15 mm. Se practicó el despliegue y la liberación de una endoprótesis aórtica bimodular de esqueleto hexagonal no anillado de níquel titanio (Nitinol), tipo EndurantTM IIs (Medtronic, Minneapolis, MN, Estados Unidos) de 28 mm. Se sobre dimensionó la endoprótesis con respecto a la aorta porcina en un 20% con el fin de obtener un máximo de agarre y penetración del dispositivo de fijación suprarrenal de la endoprótesis tipo EndurantTM IIs en la pared aórtica porcina. Se comprobó la capacidad del explantador de Cabrera para explantar la endoprótesis lesionando la menor cantidad de pared aórtica posible o no lesionarla en absoluto.
Al lograr la liberación completa de la endoprótesis EndurantTM IIs, asegurando una zona de sellado proximal de cuello aórtico sano infrarrenal de 2 cm, tal como se hace en un caso clínico real, se procedió a simular una explantación abierta, seccionando la endoprótesis por encima de su bifurcación y explantando manualmente las extensiones ilíacas de la endoprótesis. Posteriormente se acopló el explantador de Cabrera al segmento distal de la endoprótesis Endurant IIs y se procedió a activar su mecanismo, realizando una tracción sostenida y estable de los cables con la mano derecha y con la mano izquierda llevando de forma progresiva, de distal a proximal, el embudo hasta colapsar la endoprótesis. Para tener una capacidad de agarre a la endoprótesis del 100 % y evitar desgarros en el material de la misma, es clave que el explantador de Cabrera se fije tomando un segmento de Dacrón y de la estructura metálica de la endoprótesis de Nitinol (Figura 3).
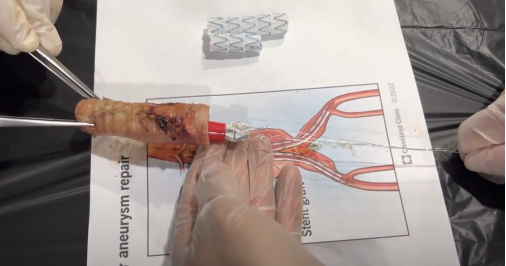
Figura 3. Activación del explantador de Cabrera. Colapso de la endoprótesis por el explantador de Cabrera y liberación de la fijación suprarrenal de la endoprótesis por el explantador de Cabrera.
El embudo se ingresó a través de la luz aórtica para que sea el embudo el único que se mueve y no se tenga que traccionar ni halar la endoprótesis, con el fin de evitar un desgarro o lesión de la pared aórtica y el endotelio. De esta manera, sólo se tracciona hacia abajo la endoprótesis cuando el embudo está completamente dentro de la luz aórtica y ha colapsado la endoprótesis y su segmento de fijación suprarrenal, para así extraerla protegida en el interior del embudo y que los ganchos de fijación de la endoprótesis no lesionen la pared aórtica (Figura 4). Se observa el paso a paso en las imágenes número 25 a 38 del vídeo.
La capacidad del explantador de Cabrera para colapsar las endoprótesis fue del 100 %, tanto para las endoprótesis de tipo anilladas como para las endoprótesis de tipo hexagonales. La capacidad para liberar los ganchos de agarre de la endoprótesis de la pared aórtica fue exitosa, tal como se observó en el video, comprobando que el explantador de Cabrera puede desacoplar los ganchos de fijación suprarrenal de la endoprótesis de la pared aórtica con un grado de lesión de la pared aórtica y de su endotelio cercano al 0 % (Figura 5). La duración de la explantación en promedio fue de 59 segundos, con un éxito en la explantación del 100 %.
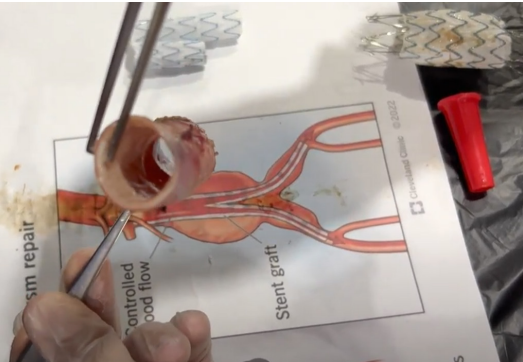
Figura 5. Resultado de la pared aórtica sin daños al finalizar la explantación de la endoprótesis por el explantador de Cabrera.
Después de los experimentos, dos cirujanos vasculares visitantes evaluaron el dispositivo, revisando de forma minuciosa todos las imágenes y videos del paso a paso de la construcción y la prueba del explantador de Cabrera. Estos dos evaluadores, estuvieron de acuerdo en que el dispositivo es factible, tiene una instalación simple y reproducible, con una rigidez y resistencia aceptable para el colapso y explantación controlada de una endoprótesis con la lesión mínima posible de la pared aórtica, con un diseño fácil de entender y emplear por cualquier cirujano vascular en el mundo. Ambos evaluadores coincidieron en que la ergonomía de la sujeción de la mano derecha debe mejorarse en futuros prototipos y que se debe extender el segmento distal del embudo de 8 mm de diámetro para disminuir al máximo el riesgo de accidentes biológicos con los ganchos de fijación de la endoprótesis.
En resumen, la ergonomía del dispositivo fue considerada “aceptable”, por lo que debe ser mejorada en los prototipos futuros, especialmente a nivel del agarre de la mano derecha y la longitud distal del embudo, para asegurar una extracción final de la endoprótesis más controlada y disminuir al máximo el riesgo de accidentes biológicos con los ganchos de la fijación suprarrenal. La resistencia de los materiales del dispositivo fue adecuada ya que no se presentaron rupturas de los alambres de Niti ni tampoco pérdidas en el agarre a nivel proximal en la endoprótesis; el embudo de PVC soportó adecuadamente el colapso de la endoprótesis y los ganchos de fijación suprarrenal, presentando una maleabilidad y maniobrabilidad aceptables.
Discusión
La adopción generalizada de la reparación endovascular de aneurismas (EVAR) durante las últimas dos décadas ha revolucionado la forma en que se tratan los aneurismas aórticos abdominales (AAA) 7,8. Según el Nationwide Inpatient Sample, más del 75 % de los AAA se reparan de forma endovascular. Esta tecnología, aunque ha tenido un gran éxito, no está exenta de riesgos, especialmente cuando se aplica en condiciones anatómicas fuera de las instrucciones de uso por parte de los fabricantes de las endoprótesis.
A medida que con el tiempo la cantidad de EVAR ha aumentado en el mundo, la frecuencia general de complicaciones tardías de EVAR que requieren explantación también ha aumentado, con una incidencia promedio de 3,7 %. Los riesgos de EVAR se relacionan con la endofuga, la durabilidad del dispositivo y la ruptura tardía, lo cual puede requerir una nueva intervención. De hecho, hasta el 30 % de los pacientes llevados a EVAR a los 10 años requieren al menos una reintervención. Afortunadamente, la mayoría de las complicaciones posteriores al EVAR se pueden tratar de forma endovascular, lo que hace que la conversión a cirugía abierta sea poco frecuente, siendo un componente valioso del armamentarium del cirujano vascular 3,9,10.
La tasa de conversión de EVAR reportada por Arnaoutakis DJ, et al. 10, fue del 1,4 %, lo que probablemente refleja la importancia en el cumplimiento estricto de las instrucciones de uso de cada dispositivo y su preferencia por realizar una reparación abierta de AAA en pacientes con anatomía limítrofe o no favorable para EVAR. El riesgo de falla del EVAR aumenta cuando los dispositivos se aplican fuera de sus instrucciones de uso por parte del fabricante, generalmente en anatomías complejas donde hay zonas de sellado proximal o distal menores de 15 mm, muy enfermas o angulaciones severas de más de 60 grados. Las fallas a menudo se pueden tratar con éxito con técnicas percutáneas relativamente simples (es decir, revestimiento con una nueva endoprótesis, manguitos de extensión o embolización). Sin embargo, cuando las reintervenciones endovasculares no tienen éxito o no están indicadas, puede ser necesaria la explantación abierta 5,10,11,12.
Muchos asocian la explantación de la endoprótesis con un procedimiento muy complejo que conlleva una mortalidad y una morbilidad sustanciales debido al alto riesgo de sangrado masivo transoperatorio y complicaciones como isquemia aguda de extremidad o infartos renales. Esta reserva probablemente se deriva de las primeras series que informaron tasas de mortalidad en el rango del 20 % al 32 % después de una explantación de endoprótesis aórtica 13. Como resultado, algunos cirujanos vasculares pueden realizar técnicas percutáneas complejas y no autorizadas (stents paralelos, endoprótesis modificadas por el mismo cirujano) en un esfuerzo por evitar los riesgos percibidos de la explantación abierta.
Estamos de acuerdo en que existen ciertos escenarios en los que tales intentos de rescate están indicados y emplearlos puede ser una opción viable. Sin embargo, la serie de Arnaoutakis DJ, et al. 10, muestra una tasa de mortalidad a los 30 días para la explantación electiva del 3,8 %, con una tasa de complicaciones mayores del 27 %. La morbimortalidad reportada para casos de explantación urgente fue cuatro veces mayor (17 %). Por lo tanto, un paciente con una falla de EVAR que no es susceptible de rescate percutáneo necesita ser evaluado de manera expedita, para que se pueda organizar la explantación electiva y de esta forma limitar al máximo la posibilidad de complicaciones intraoperatorias. En este tipo de escenarios, el explantador de Cabrera puede jugar un nuevo rol al facilitar este procedimiento y disminuir su morbimortalidad.
Las indicaciones típicas para la explantación del injerto se relacionan con endofuga, migración del injerto, oclusión del injerto o infección del injerto. Las explantaciones de injertos son procedimientos técnicamente desafiantes que generan un estrés fisiológico considerable a los pacientes, lo que lleva a tasas de morbilidad del 35 %. Está demostrado que para poder obtener un tratamiento definitivo, la explantación quirúrgica del injerto comprometido y la resección de todos los tejidos infectados con revascularización aorto-iliaca es necesaria, aunque los estudios recientes reportan una mortalidad a los 30 días de hasta el 30 %. Es allí donde el explantador de Cabrera pudiera impactar positivamente al disminuir esta mortalidad, preservando la mayor cantidad de aorta posible sana y hacer de la reconstrucción aortoiliaca un procedimiento de menor complejidad, con menor sangrado y menos tiempo quirúrgico, generando una injuria fisiológica menor al paciente 1,10,14.
Uno de los principales problemas con la extracción de las endoprótesis aórticas es el daño de los ganchos de fijación en la pared aórtica. En particular, en dispositivos con fijación suprarrenal, el desprendimiento de los ganchos del fijador suele ser traumático y complicado. Tal como lo reportan Usatii A, et al. 3 y Arnaoutakis DJ, et al. 10, se puede usar una jeringa de 20 ml para inducir un traumatismo menor de la pared aórtica. La razón principal del uso de la jeringa de 20 ml es su similitud con el diámetro de la aorta suprarrenal. También se ha reportado el uso de un proctoscopio desechable como otro método para extraer las endoprótesis, ya que la posibilidad de daño de la pared aórtica con el borde cortado y traumático de la jeringa es mayor que con el proctoscopio desechable 15. Sin embargo, es bien sabido que el costo del proctoscopio es más alto que el de la jeringa y se dispone de jeringas de 20 ml en todos los quirófanos del mundo.
Basado en los hallazgos de nuestro estudio, el explantador de Cabrera es superior a estos métodos previamente descritos de la técnica estándar para la explantación de endoprótesis aórticas empleando la jeringa septo, la cual no es efectiva en colapsar de forma controlada la endoprótesis y explantarla, sumado a la necesidad de una tracción excesiva hacia abajo de la endoprótesis creando un daño endotelial mayor y una lesión de la pared aórtica.
Al finalizar nuestro experimento, se pudo observar que no hubo lesión alguna en la pared aórtica y que el daño endotelial fue solo relegado al sitio de inserción del dispositivo de fijación suprarrenal de la endoprótesis EndurantTM IIs, además de que ejerce un colapso de la endoprótesis controlado, dinámico y continuo, y permite realizar el cierre de los ganchos de fijación suprarrenal dentro de la luz aórtica, llevando la posibilidad de lesión aórtica al mínimo. Posteriormente se puede realizar la reconstrucción vascular aórtica de forma extra anatómica o in situ 10,16,17.
La principal limitación de este estudio es su diseño experimental, con un prototipo inicial del dispositivo probado en un modelo ex vivo, con un tamaño muestral pequeño, por lo tanto, se requiere de estudios in vivo para confirmar la seguridad y factibilidad del uso del explantador de Cabrera para la explantación de endoprótesis aórticas endotelizadas en la pared aórtica, que permitan establecer volumen de sangrado y desenlaces postoperatorios.
Conclusiones
Es factible desarrollar un modelo experimental para evaluar un nuevo dispositivo para explantar endoprótesis aórticas, como el explantador de Cabrera, y comprobar su funcionamiento en un modelo animal cadavérico. El uso del explantador de Cabrera limitó el daño de la pared aórtica en un 100 % por parte de la endoprótesis al momento de su explantación en un modelo experimental ex vivo. Se requieren estudios posteriores con modelos in vivo para probar la efectividad del explantador de Cabrera asociado a endoprótesis aórticas endotelizadas. Los modelos futuros del explantador de Cabrera deben optimizar el control proximal vascular de la aorta, su bioseguridad al aumentar el control de la endoprótesis y sus ganchos de fijación al momento de la extracción de la luz aórtica, además de mejorar su ergonomía a nivel del punto de agarre de la mano derecha.