Introducción
La isquemia mesentérica crónica (IMC) es una condición infrecuente, pero con una prevalencia en aumento, alcanzando hasta el 67 % en personas mayores de 65 años 1. En reporte de autopsias, es menos prevalente que la isquemia mesentérica aguda (IMA) debido a la colateralidad dada por el tronco celíaco (TC), la arteria mesentérica superior (AMS) y la arteria mesentérica inferior (AMI) 1,2. Su principal etiología es arterioesclerótica, con mayor afectación en AMS, y tiene los mismos factores de riesgo y concomitancia con enfermedad cardiovascular 3,4.
Los síntomas de dolor abdominal crónico, de predominio postprandial (angina mesentérica), y pérdida de peso son el pilar del diagnóstico, que se confirma al visualizar estenosis u oclusión del vaso en los estudios imagenológicos. En el contexto de enfermedad multivaso es indispensable la revascularización endovascular o mediante cirugía abierta 2. El objetivo de este artículo fue presentar el caso de una paciente con hallazgo de aneurisma de aorta abdominal asociado a síntomas de IMC, que requirió manejo con corrección quirúrgica vía abierta. Se hizo también una revisión actual de la literatura.
Caso clínico
Mujer de 67 años de edad, con historia de tabaquismo activo (25 paquetes/año), hipertensión arterial, dislipidemia y desnutrición (índice de masa corporal de 17,9 kg/m2), en manejo farmacológico con enalapril 20 mg dos veces al día y rosuvastatina 40 mg cuatro veces al día, que consultó por un cuadro clínico de una semana de evolución consistente en cefalea tipo pulsátil holocraneana, intensa (EVA 7/10), asociada a dolor abdominal “desgarrante”, con sensación de masa pulsátil en mesogastrio. Al examen físico de ingreso se encontró presión arterial de 178/110 mmHg en brazo derecho y 185/109 mmHg en brazo izquierdo, frecuencia cardiaca de 76 lpm, saturación de oxígeno de 94 % al ambiente, con ruidos cardiacos rítmicos y electrocardiograma dentro de limites normales.
Se abordó inicialmente como posible patología aórtica aguda, con indicación de monitoreo invasivo en unidad de cuidado intensivo (UCI) con soporte con labetalol en infusión continua, con control de cifras tensionales sistólica por debajo de 120 mmHg. Se realizó de carácter emergente tomografía computarizada con protocolo de aorta, en la cual se documentó aneurisma de aorta toracoabdominal Crawford IV de 38x39 mm con oclusión aorto-ilíaca TASC D y oclusión crónica del TC y AMS, con recanalización en el tercio medio de esta última (Figura 1).
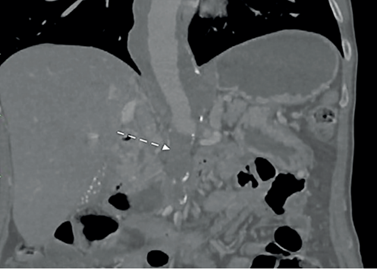
Figura 1. Tomografía de abdomen con angiograma donde se observa un aneurisma toracoabdominal y oclusión aorto-ilíaca (flecha).
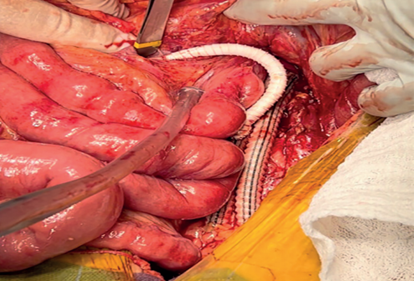
Durante estancia en UCI se hizo nuevo interrogatorio y la paciente refirió cuadro de dos años de evolución de dolor abdominal postprandial, con cibofobia y pérdida progresiva de peso. Fue llevada a manejo quirúrgico, previa heparinización sistémica (100 UI/kg), para baipás aorto-bifemoral más baipás retrogrado aorto-mesentérico superior. Mediante abordaje transperitoneal, se procedió a la disección de aorta abdominal infrarrenal, pinzamiento y corte de aorta yuxtarrenal, preparación de vasos receptores (arterias femorales y AMS en tercio medio), baipás aorto-bifemoral con injerto de dacrón de 14x7 mm y, posterior a la reperfusión de los miembros inferiores, se realizó pinzamiento parcial de la rama derecha del baipás para continuar el baipás retrogrado injerto-AMS con injerto de PTFE anillado de 8 mm, en forma de C, sin complicaciones (Figura 2).
La paciente presentó una adecuada evolución posoperatoria, con apoyo nutricional parenteral y tolerancia a la vía oral al tercer día, por lo cual fue dada de alta al quinto día posquirúrgico. En el seguimiento ambulatorio, en los quince días había tenido ganancia de 2 kg y al tercer mes, 13 % de ganancia de peso comparado con el de ingreso a urgencias (36 kg versus 41 kg). Se realizó ecografía dúplex de las arterias viscerales con permeabilidad del baipás, sin evidencia de complicaciones. Se ajustó el manejo de sus comorbilidades, la hipertensión arterial con inhibidor de enzima convertidora de angiotensina (IECA) y bloqueador de canal de calcio, estatina de alta intensidad a metas de LDL menor de 55 mg/dL, apoyo nutricional y cese de tabaquismo.
Discusión
La isquemia mesentérica es una condición de hipoperfusión de la mucosa intestinal, siendo la causa del 0,1 % de todas las admisiones hospitalarias y el 2 % de las admisiones por síntomas gastrointestinales, con rangos de mortalidad del 30 % al 70 % 2. Puede ser dividida en isquemia mesentérica aguda y crónica. La primera con una subdivisión, dependiendo de la etiología, dada por embolismo arterial, trombosis arterial, trombosis venosa mesentérica y causas no oclusivas mediadas por hipoperfusión o vasoconstricción 5.
La IMC es una entidad infrecuente. Desde las primeras descripciones hechas por Baccelli en 1918 6, muestra una prevalencia en aumento, con datos que van desde el 6 % a los 40 años hasta el 67 % en pacientes mayores de 75 años 1. Registros de autopsias 7 informaron una prevalencia de 0,03 %, un valor bajo comparado con la IMA, lo cual es explicado por la colateralidad de los remanentes embrionarios, que funcionan como un mecanismo de defensa 1,2. Es una entidad cuyo diagnóstico se puede pasar por alto; hay estudios que muestran que desde el inicio de los síntomas hasta el diagnóstico pueden pasar 20 a 25 meses, incluso en cohortes de IMA, donde el 84 % tenían síntomas previos de IMC 3,8,9.
La etiología de la IMC en más del 90 % de los pacientes es debida a arterioesclerosis, siendo mayor el compromiso en AMS. Otras causas son displasia fibromuscular, vasculitis y compresión de ligamento arcuato. Entre las etiologías no oclusivas, la denominada “migraña abdominal”, que es diagnosticada en el 13 a 16 % de todas las IMC, la causa es falla cardiaca, cortocircuito (shunt), microémbolos, vasoespasmo o disfunción autonómica 4,5. Dentro de los factores de riesgo descritos están hipertensión arterial, tabaquismo, dislipidemia y obesidad 1; y es clara la relación con otras patologías cardiovasculares como enfermedad coronaria (50-70 %), cerebrovascular (40 %) y enfermedad arterial periférica (30 %) 5.
El compromiso arterioesclerótico asintomático es reportado en el 3 % en menores de 65 años y hasta 16 % en mayores de 65 años; para desarrollar la síntomas de IMC, los pacientes deben tener una enfermedad multivaso, con una red colateral insuficiente entre TC, AMS y AMI. Hay que entender que el flujo en reposo en TC es 450 ml/min y en AMS es 400 ml/min, y posterior a la ingesta debe tener un cambio dinámico hasta 700 mil/min y 800 mil/ min respectivamente, con una temporalidad de 3 horas, lo cual es un mecanismo alterado en IMC 1,4.
Los síntomas cardinales son el dolor abdominal, de predominio en epigastrio y mesogastrio, 20 a 30 minutos postprandial, con una duración de hasta 2 horas. La temporalidad de los síntomas es mayor a tres meses y suele asociarse a nauseas, pérdida de peso, diarrea (7-35 %) y constipación. Puede ser confundido con síntomas de síndrome de intestino irritable, gastroparesia o dispepsia 4. Incluso en pacientes de avanzada edad, la sintomatología es muy bizarra, lo cual establece un pronóstico peor debido al diagnóstico tardío 10.
El diagnóstico clínico es limitado, por lo cual se debe apoyar en imágenes como la angiografía por tomografía computarizada, que tiene una sensibilidad de 100 % y una especificidad de 95 % para estenosis de AMS. El dúplex es operador dependiente, con valores de velocidad pico sistólica en AMS mayor a 275 cm/seg y en TC mayor a 200 cm/seg; en estenosis de TC mayor del 70 %, con una sensibilidad del 72-100 % y una especificidad del 77-99 %, y para estenosis de AMS mayor del 70 %, con una sensibilidad del 72-100 % y una especificidad del 84-98 %. Otros estudios útiles son angiografía por resonancia magnética, angiografía por sustracción digital, espectroscopia por luz visible mediante endoscopia y tonometría por sonda nasoyeyunal o nasogástrica para medir PCO2 (estos dos últimos útiles como estudio funcional de IMC) 4.
El tratamiento cumple la finalidad de mejorar los síntomas, la calidad de vida, aumentar de peso y prevenir un infarto intestinal. Se recomienda la revascularización en IMC con síntomas persistentes. Es el pilar fundamental ante el hallazgo de enfermedad multivaso, sin embargo, en estenosis de un solo vaso, se ha tenido mejoría de los síntomas hasta en el 73 % de los pacientes sometidos a este procedimiento 4.
Una de las opciones para revascularización es la terapia endovascular, mediante un procedimiento mínimamente invasivo practicado por vías transfemoral, transbraquial o transradial, con un aumento en su uso en los últimos veinte años; actualmente se recomienda el uso de stent recubierto 11. Las limitaciones de este procedimiento suelen observarse en lesiones oclusivas largas y con compromiso ostial de la emergencia en la aorta, calcificación excéntrica severa y lesiones en tándem a lo largo de los vasos. Todos estos hallazgos no contraindican dicha estrategia, sin embargo, están asociado a mayor tasa de fallo terapéutico. Dentro de las complicaciones, se presenta la embolización distal en el 8 % de los pacientes sin uso de sistema de protección embolica, más frecuente en pacientes con síntomas subagudos, oclusiones totales, lesiones con calcificación severa y longitud de la lesión mayor de 30 mm. Otras complicaciones se relacionan con el sitio del acceso vascular en el 3-16 %, isquemia intestinal en el 1-8 % e injuria renal en el 2,8 % 4,5.
El manejo quirúrgico por vía abierta es una opción si la terapia endovascular falla o no es susceptible de realizarse, con tasas de éxito del 97-100 % y complicaciones descritas en el 13-40 % 2. Las opciones son anterógrada (desde la aorta supracelíaca), retrógrada (desde la arteria iliaca), o hibrido, donde se hace exploración de la arteria mesentérica superior, con posterior endarterectomía e instalación del stent por vía endovascular bajo visión directa 4. Hay condiciones que se relacionan con pobres desenlaces, como arterias aorto-ilíacas muy tortuosas, segmento de oclusión muy largo, vasos distales de pequeño diámetro y estenosis muy calcificadas, por lo que son contraindicaciones relativas 12.
En el caso documentado, por la presencia de un aneurisma de aorta toracoabdominal asociado a oclusión aorto-ilíaca TASC D y a IMC descritas, debido a las condiciones clínicas críticas y su alto riesgo quirúrgico, se consideró mejor un tratamiento del segmento infrarrenal mediante reemplazo de aorta abdominal infrarrenal con baipás aorto-bifemoral de dacrón más baipás retrogrado al tercio medio de la arteria mesentérica superior con injerto PTFE anillado.
Conclusión
La IMC es una condición subdiagnosticada, que se convierte en un marcador de riesgo cardiovascular, con alta carga de morbilidad y mortalidad, en el cual con una identificación temprana se puede ofrecer una terapia de revascularización, por vía endovascular o abierta, con el fin de mejorar la calidad de vida, la ganancia de peso y evitar necrosis intestinal.