Epidemiología y factores de riesgo
El cáncer de pene no es una patología frecuente; en Colombia, ocupa el puesto número 21, de acuerdo a las estadísticas de Globocan de 2020.1 De acuerdo con Cataño et al., 2 "En Colombia la tasa de incidencia anual de Cáncer de Pene según un estudio3 realizado por la Universidad del Valle en 2004 es de 1.11 por 100.000 habitantes algo muy similar a otros países del mundo. La edad de presentación de esta patología es variable siendo la media en Colombia 52 años, pero se puede observar en pacientes jóvenes o ancianos".
El carcinoma de células escamosas (CCE) representa más del 95% de las neoplasias malignas del pene. 4-7
Se han identificado distintos tipos histológicos de CCE peneano con diferentes patrones de crecimiento, agresividad clínica, y asociaciones con virus del papiloma humano (VPH). Existen numerosas formas mixtas, como la verrugosa-basaloide, que se presenta en 50% a 60% de los casos, la verrugosa habitual (híbrida), la basaloide habitual, y la papilar habitual, así como otras combinaciones poco frecuentes (Tabla 1).
Tabla 1 Lesiones asociadas a carcinoma de células escamosas y lesiones premalignas

Nota: Extraída de la guía de la European Association of Urology (EAU), 2018. 77
CCE, carcinoma escamocelular.
Se han descrito distintos factores de riesgo, entre ellos la inflamación crónica, el tabaquismo, la infección por VPH (variantes 16 y 18), bajo nivel socioeconomico, promiscuidad, e inicio temprano de relaciones sexuales.
Evaluación diagnóstica y estadificación
En las lesiones en pene que sean dudosas, se deberá realizar una verificación histológica con biopsia; con este resultado, se define el tratamiento local de la lesión. La confirmación histológica es necesaria para guiar el manejo en el caso de que la naturaleza de la lesión no esté definida (neoplasia intraepitelial del pene [PeIN], metástasis o melanoma), o se planee tratamiento con agentes tópicos, radioterapia, o cirugía láser. 9,10
Si bien se ha descrito5 que las biopsias por punción podrían aportar información suficiente para el diagnóstico la patología, actualmente se recomienda la toma de biopsias por escisión, pues se logra mayor material, de mejor calidad, lo que permite evaluar la profundidad de la invasión, el grado de diferenciación, y la extensión de las lesiones (Tabla 2).
Diagnóstico de la lesión primaria
Se debe realizar un examen físico completo, en el cual se debe incluir la palpación de la totalidad del pene y evaluar la morfología, extensión e invasión de sus estructuras. En el caso de encontrar fimosis, se debe reducir en su totalidad para evaluar dichas características; de igual manera, se debe realizar la palpación inguinal bilateral para evaluar el estado de los ganglios linfáticos, es decir, si hay adenopatías palpables o por el contrario son no palpables. 11
Entre las técnicas imagenológicas que se pueden emplear para evaluar el compromiso de los cuerpos cavernosos en los casos en que se plantee una cirugía conservadora de órgano, se encuentra el ultrasonido, la resonancia magnética con inducción artificial de la erección, 12,13 y la ecografía Doppler de pene, que tiene una precisión de estadificación más alta que una resonancia magnética para detectar infiltraciones de los cuerpos. 14 La sensibilidad y especificidad de la resonancia magnética para predecir las invasiones corporal y uretral se han informado en 82,1% y 73,6%, y 62,5% y 82,1%, respectivamente. 15
Diagnóstico de ganglios linfáticos regionales y metástasis a distancia
Se debe realizar un examen físico exhaustivo de la región inguinal para determinar el número de lesiones, la lateralidad, y las características de los ganglios. En el caso de que no haya enfermedad nodal papable, se debe ofrecer estratificación invasiva en pacientes de riesgo intermedio y alto y, como sean palpables, se debe realizar exámenes de imágenes de extensión con tomografía axial computarizada (TAC) de abdomen, 16 tomografía por emisión de positrones, 17,18 y radiografía de tórax como estudio de extensión19 (grado de recomendación: fuerte).
En pacientes con enfermedad metastásica a distancia o que presente síntomas relevantes como el dolor oseo se debe obtener una gamagrafía osea, con grado de recomendación fuerte.
Tratamiento de la lesión primaria
Los manejos tópicos están reservados para enfermedades superficiales y no invasivas, siendo las opciones de tratamiento que cuentan con grado de recomendación fuerte:
El objetivo de la cirugía preservadora tiene como objetivo mantener un resultado oncológico, que preserve la cosmética y la funcionalidad.
Otras alternativas de manejo para pacientes con enfermedad superficial son la cirugía de escisión, la radioterapia de haz externo, y la braquiterapia.
Manejo de enfermedad T1/T2
La elección del tratamiento depende del tamaño del tumor, de la historia, del estadio, del grado, y de la localización.
Las alternativas terapéuticas que cuentan con grado de recomendación fuerte son la escisión local, glansectomia parcial o total con reconstrucción, contando con tasas de recurrencia local del 7.6% y supervivencia global a 5 años de 85%, tasa de amputación de rescate de 1%. En cuanto a los márgenes quirúrgicos específicamente, no hay evidencia clara sobre el ancho de los márgenes, la recomendación general de seguridad es de 3-5 mm. Si se utiliza un enfoque de manejo basado en el grado del tumor, se puede tomar como margen seguro 3 mm para el grado uno, 5 mm para el grado dos y 8 mm para tercer grado. 31,32
La radioterapia también puede considerarse como tratamiento para pacientes con lesiones menores de 4 mm.
Manejo de enfermedad T2/T4
Las opciones de tratamiento en este grupo de pacientes son la glansectomía total con o sin resurfacing, con esquema de seguimiento estricto, o penectomía parcial. 33
Para pacientes con estadio T3, las opciones de manejo son la glansectomía más corporectomía distal y reconstrucción; 31-34 para el estadio T4, las opciones de manejo son la amputación parcial extensa, penectomía total más uretrostomía perineal, y evaluación de quimioterapia neoadyuvante en pacientes con tumores difícilmente resecables, extensos o ulcerados. 35
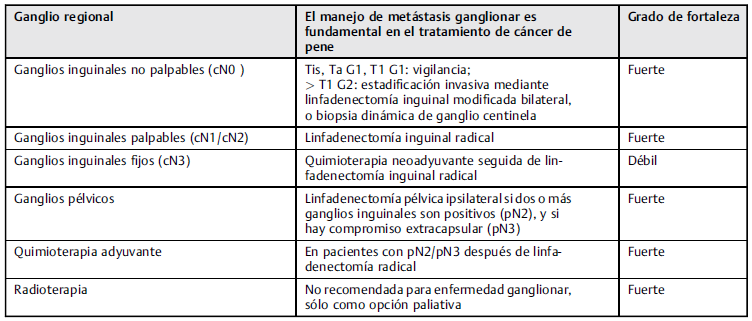
Manejo de enfermedad ganglionar
El drenaje linfático es predecible, y es estratificado inicialmente a los ganglios inguinales superficiales y profundos, y, posteriormente, pélvicos. 36
En casos de ganglios linfáticos inguinales clínicamente normales, se deberá estratificar de manera detallada a los pacientes para considerar linfadenectomía temprana, teniendo en cuenta una supervivencia a largo plazo del 90%.23,24
Los pTa/pTis y pT1 G1 no son acrónimos, es de acuerdo a la clasificación expuesta en la Tabla 2. 26-28
Los pacientes con patología pT1G2 son considerados de riesgo intermedio, y se aconseja la estratificación invasiva ganglionar con ganglio centinela o linfadenectomía modificada. 37-39
Respecto a los con patología pT1G3, se consideran pacientes de alto riesgo para considerar estadificación ganglionar invasiva. 23,24
Para pacientes con patología pT2-pT4, se indica estadificación ganglionar invasiva. 40
Manejo de pacientes con ganglios inguinales palpables (cN1/cN2)
Existe una alta probabilidad de compromiso metastásico en pacientes con adenopatías palpables unilaterales o bilaterales; por lo tanto, el uso de antibiótico en estos pacientes no debe considerarse una práctica de rutina, pues puede conllevar a un retraso peligroso en el tratamiento curativo.
Los ganglios palpables deben ser removidos quirúrgicamente y llevados a estudio por congelación; en caso de ser positivos, se deberá realizar una linfadenectomía inguinal radical. 41
Linfadenectomía inguinal radical
La linfadenectomía inguinal radical conlleva una morbilidad significativa de hasta el 50%, se ha demostrado que especialmente en pacientes obesos, el drenaje linfático de escroto y las piernas puede verse afectado con el procedimiento (nivel de evidencia: 2b). La linfadenectomía inguinal radical puede salvar vidas, por lo que no debe retrasarse por temor a la morbilidad asociada. 45 La morbilidad postoperatoria puede reducirse conservando la vena safena y con el uso de medias de compresión para mejorar el drenaje; el uso de apósitos con presión inguinal o succión al vacío con antibióticos profilácticos también pueden contribuir a una mejor evolución postoperatoria. 46 La linfadenectomía inguinal bilateral deberá considerarse en pacientes con características de alto riesgo y ganglios palpables, considerando que un 30% de ellos pueden tener compromiso metastásico contralateral. 47
Manejo de pacientes con ganglios inguinales fijos (cN3)
Los pacientes con ganglios inguinales fijos requieren quimioterapia neoadyuvante seguida de linfadenectomía radical. 48-50 Dicha linfadenectomía deberá realizarse de cuatro a seis semanas después de la quimioterapia. 51 Los pacientes que responden a este manejo tienen una supervivencia a largo plazo de 37%,48 y algunos estudios han confirmado este beneficio. 49,50,52,53
Linfadenectomía pélvica
Los pacientes con metástasis en dos o más ganglios linfáticos inguinales unilaterales, o con extensión extracapsular, deben ser llevados a linfadenectomía pélvica ipsilateral. Todo esto se basa en un estudio54 en el que se encontró una tasa de ganglios pélvicos positivos de 23% cuando habían dos ganglios inguinales positivos, y del 56% en aquellos con más de 3 ganglios inguinales positivos o con extensión extracapsular. 38-54
Los factores de riesgo relacionados con metástasis a ganglios pélvicos son: el número de ganglios inguinales positivos (punto de corte de 3), el diámetro de los ganglios metastásicos (30 mm), y la extensión extracapsular. El porcentaje de compromiso metastásico pélvico fue de 0% sin ningún factor de riesgo, y de 57.1% con los tres factores de riesgo presentes, en un estudio de Tobías-Machado et al. 55 La linfadenectomía pélvica se puede realizar simultáneamente en caso de que se presenten en el estudio por congelación más de tres ganglios positivos, 54-56 o de forma diferida de la linfadenectomía de los ganglios iliacos internos, externos, y obturadores (Tabla 3). 57
Quimioterapia
Tratamiento adyuvante
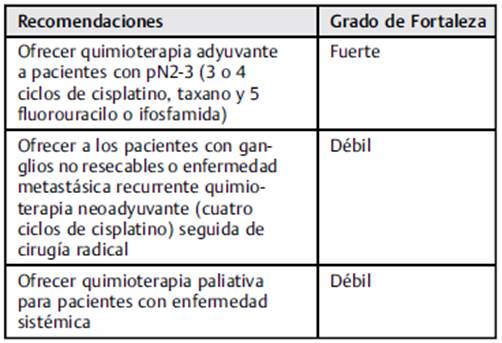
En pacientes con estadio pN2/pN3, la quimioterapia adyuvante se debe realizar tras la linfadenectomía, pues la supervivencia libre de enfermedad fue de 84% en pacientes con quimioterapia adyuvante, contra 39% en los controles sin quimioterapia después de la linfadenectomía en un estudio de Lucky et al. 58
De acuerdo a un estudio realizado por Giannatempo P., et al, donde incluyeron pacientes PN2-PN3, el uso de quimioterapia adyuvante, 5 fluorouracilo (5-FU) con placitaxel o docetaxel (TPF), con 3 o 4 ciclos después de la linfadenectomía demostró una tasa de 52.6% de supervivencia libre de enfermedad después de una mediana de seguimiento de 42 meses con buena tolerabilidad. 59 Se recomienda quimioterapia adyuvante, especialmente cuando su uso es factible y existe una intención curativa (NE: 2b). No hay datos que soporten la quimioterapia adyuvante en pN1.
Quimioterapia neoadyuvante en pacientes con ganglios inguinales fijos o recidivantes
La quimioterapia neoadyuvante permite un tratamiento temprano de la enfermedad sistémica y la reducción del tamaño de la metástasis en los ganglios linfáticos.
El uso de 5-FU con cisplatino y docetaxel tiene una tasa de respuesta objetiva comparable con la alcanzada con placitaxel, ifosfamida y cisplatino en pacientes con cN3. Sin embargo, las tasas de toxicidad se han reportado entre 20% y 25%.60,61
Con tales hallazgos, se aconseja el uso de quimioterapia neoadyuvante en pacientes con ganglios fijos, no resecables, con grado cero en la escala del Eastern Cooperative Oncology Group (ECOG 0), y que tengan una función renal preservada. 62,63 No se recomienda el uso de quimiorradioterapia. 64
Quimioterapia paliativa en enfermedad avanzada o tras recaída
Los regímenes basados en platinos tienen mejores resultados. 54 Sin embargo, la introducción de los taxanos ha incrementado la eficacia y la actividad de los esquemas utilizados. 36,49,50,52,65-69
No existen datos que soporten el uso de quimioterapia en segunda línea. Un estudio65 reportó una tasa de respuesta < 30% en pacientes con monoterapia con placitaxel en segunda línea. Se ha observado un beneficio con cisplatino en segunda línea adicionando gemcitabine (Tabla 4). 66
Seguimiento
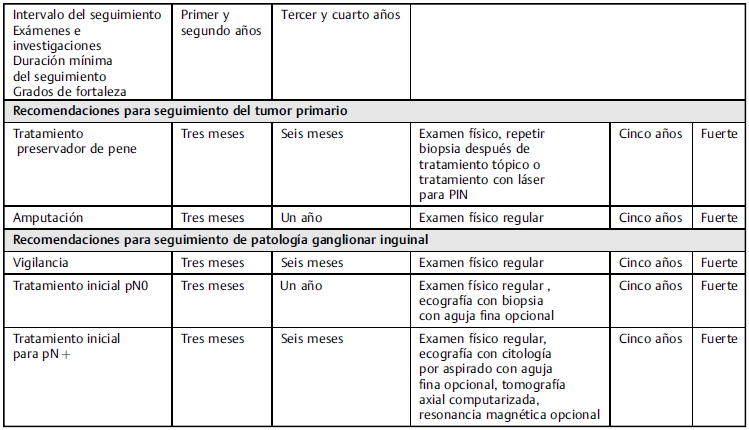
El seguimiento estricto de estos pacientes permite la detección precoz de recidiva con el fin de poder brindar un tratamiento con intención curativa. 36,68 En enfermedad metastásica, el seguimiento es importante para poder detectar complicaciones relacionadas con el tratamiento. Las recidivas suelen presentarse a los dos años de tratamiento. 23
Cuándo y cómo hacer el seguimiento
Después del manejo primario en pacientes con ganglios negativos, se debe hacer el seguimiento con examen físico adecuado del pene y la región inguinal, y no se requieren de imágenes adicionales, pues no muestran ningún beneficio.
En pacientes tratados con terapia de ablación láser o terapia tópica, se debe tener un reporte histopatológico que confirme el estado libre de enfermedad.
Después de los cinco años, existe poca probabilidad de recidiva; por tal motivo, se puede suspender el seguimiento después de este tiempo. 70 Sin embargo, en pacientes que no puedan realizarse el autoexamen, será necesario un seguimiento más largo.
Recurrencia del tumor primario
Las tasas de recurrencia son más altas en pacientes sometidos a tratamientos locales, sin afectar en la supervivencia específica al cáncer. 71,72 En un estudio, 20 se reportó una recidiva local en los dos primeros años de hasta un 27%. Después de una penectomia parcial, el riesgo de recidiva local es del 4% al 5%.20,36
Recurrencia regional
La tasa de recurrencia regional en pacientes sometidos a vigilancia es casi del 9%, mientras que es más baja (2,3%) en pacientes sometidos a linfadenectomía inguinal modificada con ganglios negativos. El uso de ecografía y citología por punción aspirativa con aguja fina (PAAF) en casos sospechosos ha mejorado las tasas de detección precoz de recurrencia regional. 36,68,73 Los pacientes sometidos a linfadenectomía sin tratamiento adyuvante tienen un riesgo aumentado de recidiva regional del 19%.17
Guías para seguimiento de cáncer de pene (Tabla 5)
Calidad de vida
Consecuencias después del tratamiento para cáncer de pene
En pacientes sometidos a tratamiento quirúrgico para cáncer de pene, la disfunción sexual, la micción, y la apariencia cosmética pueden afectar su calidad de vida. 71 En un estudio comparativo78 de escisión local amplia versus penectomía, hubo una reducción en el Índice Internacional de Función Eréctil (International Index of Erectile Function, IIEF, en inglés) postoperatorio en los pacientes sometidos a glandectomía. En otro estudio, 79 se observó una afectación de la calidad de vida con respecto a problemas de eyaculación, estética y alteración en la función miccional en los pacientes sometidos a penectomia parcial versus cirugía preservadora de pene (83% versus 43%; p < 0,0001), pero no hubo diferencias en la función eréctil y en la satisfacción sexual.
Actividad sexual y calidad de vida después de tratamiento con láser
En un estudio23 con una muestra de 224 pacientes, no se reportaron problemas en la función eréctil o sexual después del tratamiento.
Actividad sexual después de desepitelización del glande
En un estudio77 con 10 pacientes, 7 contestaron el cuestionario IIEF-5 a los 6 meses, y la puntuación mediana fue de 24. Todos los pacientes manifestaron que la sensación del glande no era diferente o mejor después de la cirugía, y cinco de ellos manifestaron mejoría en su vida sexual.
Actividad sexual después de glansectomía
En un estudio74 con una muestra de 68 pacientes, 78 79% no reportaron cambios en la erección o capacidad para la penetración después de la cirugía, y 75% habían recuperado el orgasmo.
Función sexual después de penectomía parcial
En un estudio75 con 18 pacientes con mediana de edad de 52 años, las puntuaciones en el IIEF fueron peores en todos los ítems de la función sexual después de la cirugía; el 55.6% de los pacientes tenían una función eréctil que les permitía tener relaciones sexuales. Un 50% de los pacientes no reanudó su actividad sexual por el tamaño de su pene. Un 66.7% de los pacientes reanudaron las relaciones sexuales, y manifestaron tener la misma frecuencia y nivel de actividad sexual, y el 72.2% preservaron la eyaculación y el orgasmo.
Calidad de vida y función sexual tras penectomia total
Tras amputación del pene en diez pacientes, 76 se reportaron efectos significativos en la vida sexual y en la calidad de vida; sin embargo, no hubo implicaciones negativas en términos de la relación en pareja, la autoconfianza y la evaluación de la masculinidad.