introdução
Atualmente são reconhecidos 8 géneros e 23 espécies viventes de crocodilianos que são divididas nas Famílias Crocodylidae, Alligatoridae e Gavialidae, pertencentes à subordem Eusuchia 1 . As cinco espécies de crocodilianos que ocorrem no Brasil pertencem à Família Alligatoridae, popularmente chamadas de jacarés 2 , Caiman crocodilus, Melanosuchus niger, Paleosuchus trigonatus, Paleosuchuspalpebrosus e Caiman latirostris. Destas, apenas C. latirostris não ocorre na Amazônia 1 .
A espécie M.niger vulgarmente conhecida como jacaré-açu, apresentam focinho largo, liso e com uma notável crista pré-ocular, coloração dorsal negra com listras verticais brancas ou amareladas, e na mandíbula manchas acinzentadas nos jovens e marrom nos adultos 3 , podem alcançar 6 m de comprimento total 4 , apresentam tamanho médio da ninhada de 34 ovos, variando entre 23 e 48 5 e as populações naturais sofrem impactos de ações antrópicas, tais como a criação de represas, o desmatamento e a caça 6 . Já o jacaretinga, C. crocodilus, é caracterizada por uma crista ou testa em crescente localizado logo acima dos olhos e sobre o dorso do focinho, apresentam uma crota ossificada em frente dos olhos, os juvenis são amarelos com manchas pretas nos lados do corpo e cauda, já os adultos, modificam sua coloração para verde-oliva escuro 3 . Podem alcançar 2,5m de comprimento total 7 e o número médio de ovos encontrado é de 25, variando de 14 a 38 8 . Os impactos sobre a espécie são os mesmos relatados para M. niger.
Crocodilianos predam grande variedade de invertebrados e vertebrados 2,3 , e sua estratégia oportunista de alimentação pode afetar seu comportamento, condição corporal, crescimento e reprodução 4 . Como observado nos estudos de Barão-Nóbrega et al 3 , que concluíram que fémeas de C. crocodilus, em período de nidificação, ou seja, períodos duradouros de privação alimentar, consomem presas disponíveis nas proximidades do ninho. Na maioria das espécies é observado um incremento de até 70% no consumo de peixes, e um maior consumo de presas maiores, à medida que os indivíduos aumentam de tamanho 5 .
As espécies Melanosuchus niger (Spix, 1825) e Caiman crocodilus (Linnaeus, 1758) habitam simpatricamente o lago Cuniã, Rondônia. Embora a dieta e o comportamento alimentar de ambas as espécies tenha sido investigada 2,4,9,10,11,12 , ainda são poucas as informações sobre a dieta destas espécies no Estado de Rondônia e em áreas protegidas na Amazônia, principalmente em uma RESEX que apresenta como principal recurso explorado as espécies M. niger e C. crocodilus. Nesse sentido, o presente estudo teve por objetivo avaliar a composição da dieta de C. crocodilus e M. niger na Reserva Extrativista do Lago Cuniã (Resex Cuniã), Rondônia, Brasil.
Materiais e métodos
A Resex Cuniã (Figura 1) localiza-se a cerca de 130 km do município de Porto Velho. A estação chuvosa ocorre de novembro a abril e a estação seca de maio a outubro 13 .
O Lago Cuniã é uma importante área protegida, localizada na Reserva Extrativista do Lago do Cuniã (RESEX Cuniã), que apresenta mais de 140 espécies de peixes 6,7 , sustenta pescarias locais sujeitas a um plano de gestão ambiental e outras atividades de uso sustentável dos recursos naturais 6,14 como a captura e abate de jacarés. Com uma área superficial de 18.000 ha o Lago Cuniã esta situado na parte inferior do rio Madeira, e compreende um complexo de aproximadamente 60 lagos e canais, que são interconectados durante o período de enchente do rio, abrigando grandes áreas de macrófitas aquáticas, liteira submersa, troncos marginais e sendo um dos poucos lagos de várzea de grande porte com águas turvas 7 , promovendo uma grande complexidade estrutural, que contribui para a grande biodiversidade animal na área.
O Lago Cuniã apresenta a população de jacarés com o número de machos superior ao número de fémeas 15 . A Cooperativa da Resex (COOPCuniã) foi fundada em abril de 2011 no intuito de comercializar os produtos da RESEX 16 . A Resex Cuniã produz farinha, açaí, castanha-do-brasil e explora o manejo de algumas espécies de peixes e duas espécies de jacarés, C. crocodilus e M. niger16 . A cooperativa é gerenciada por um grupo de Gestores que são responsáveis pelas atividades dentro e fora da RESEX, mas o objetivo de todas as atividades da cooperativa é garantir o cumprimento de sua missão: "realizar o manejo dos recursos com foco na sustentabilidade" 16 . O modelo de produção seguido na RESEX é do tipo harvesting, autorizado em 2011 pelo IBAMA com finalidade de controle populacional.
Os jacarés machos de ambas as espécies foram capturados no lago da Resex Cuniã, em novembro de 2016, pelos membros da COOPCuniã. As capturas foram realizadas à noite, usando laço (enforcador) de cabo de aço. Após a captura, os animais foram contidos em curral redondo, foram tomadas as medidas biométricas de comprimento total (m) com auxílio de uma trena e massa total (kg) com uma balança de 0,1 g de precisão e peso máximo de 100.000g e higienizados. Posteriormente os indivíduos foram abatidos com pistola pneumática na área interna do frigorífico, eviscerados e os estômagos foram fornecidos para análise. As amostragens foram autorizadas pelo Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio, Licença: 53594-1/2017).
Os estômagos foram armazenados em alcool a 70% e os itens alimentares foram analisados e identificados ao menor nível taxonômico possivel. A frequência de ocorrência (%Freq.) e a frequência volumétrica (%Vol.) foram utilizadas para quantificar o conteúdo dos estômagos 17 . A %Freq. foi calculada pelo número de estômagos que continham cada item alimentar, calculando a porcentagem em relação ao total de estômagos. Para o %Vol., o volume de cada item foi obtido usando a porcentagem em relação ao valor total de cada conteúdo do tubo digestivo. O volume foi mensurado utilizando uma proveta graduada, onde o volume foi medido em mililitro 18 . Esses dados foram combinados no Índice de importância alimentar (IAi) proposto por Kawakami & Vazzoler 19 e adaptado por Hahn et al 20 , de acordo com a equação: IAi = (Fi * Vi) / S(Fi * Vi)) * 100, onde i = 1, 2,... n de itens alimentares; Fi = frequência de ocorrência de um determinado item alimentar; Vi = volume de um determinado item alimentar. Foi calculada a frequência de ocorrência dos itens alimentares ingeridos pelas espécies, sendo estes classificadas segundo a escala de Dajoz 21 como: constantes, quando o item está presente em mais de 50% das amostras; acessórias, entre 25 e 50% e acidentais, em menos de 25% das amostras. Nesse caso cada amostra representou um estômago.
Resultados
Foram analisados um total de 82 estômagos, 42 de M. niger e 40 estômagos de C. crocodilus. O comprimento e massa média de M. niger foram de 1,8 ± 0,1 m e 17,0 ± 5,5 Kg e de C. crocodilus foram de 1,7 ± 0,1 m; 19,0 ± 5,0 Kg, respectivamente. Ambas as espécies ingeriram um total de 14 itens alimentares, variando em itens de origem animal, como fragmentos de aves, fragmentos de peixes, anfíbios, crustáceos e insetos, e itens de origem vegetal, como Brachiaria sp (Figura 2 e 3). Os itens Hoplosternum littorale (IAi = 0,55), seguido de Brachiaria sp. (IAi = 0,20) e penas (IAi = 0,11) foram os mais ingeridos por C. crocodilus, enquanto para M. niger os itens mais importantes foram Brachiaria sp. (IAi = 0,39), Characiformes sp 1 (IAi = 0,19) e Loricariidae (IAi = 0,17; Tabela 1; Figura 4).
Tabela 1 Frequência relativa (% Freq.), Volume (% Vol.) e Índice de importância alimentar (IAi) de C. crocodilus e M. niger na Resex Lago do Cuniã, coletados em novembro de 2016. Con = constantes, Ace = acessórias e Aci = acidentais 19 .
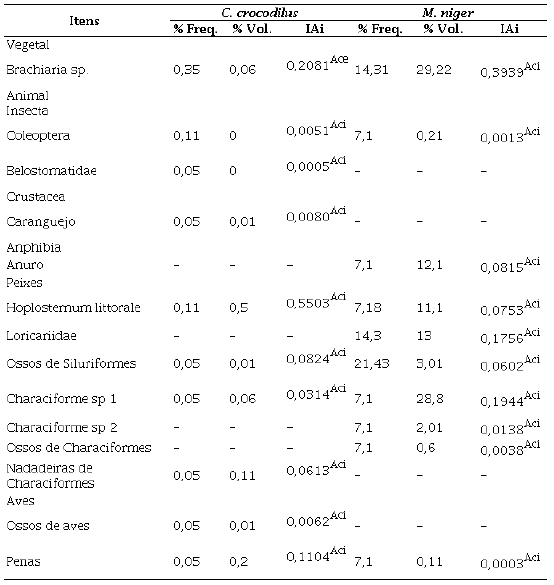

Figura 2 Percentual de frequência relativa dos itens alimentares consumidos por C. crocodilus e M. niger na Resex Lago do Cuniã, coletados em novembro de 2016

Figura 3 Percentual de volume dos itens alimentares consumidos por C. crocodilus e M. niger na Resex Lago do Cuniã, coletados em novembro de 2016.

Figura 4 Itens alimentares da dieta de M. niger e C. crocodilus na Resex Lago do Cuniã, Rondônia. A: esqueleto de peixe da Ordem Siluriformes. B: ossos e epiderme de anuro. C: penas. D: Brachiaria sp. com presença de nematoides.
As espécies de jacarés estudadas consumiram uma variedade de itens alimentares, todavia os itens mais representativos em volume, frequência e número de espécies relacionam aos peixes. Espécies do grupo dos Characifomes, Perciformes, Siluriformes, Beloniformes, Symbranchiformes e Osteoglossiformes também foram encontrados em conteúdos estomacais de C. crocodilus22 e M. niger23 , no Pantanal e bacia amazônica, respectivamente.
Discussão
Os peixes foram o item mais consumido por ambas as espécies estudadas no lago Cuniã. As espécies C. crocodilus e M. niger ingeriram um total de 14 itens alimentares, todavia C. crocodilus consumiu uma maior variedade de itens invertebrados enquanto M. niger ingeriu mais itens do grupo dos vertebrados. Os crocodilianos são predadores generalistas, se alimentam de uma variedade de presas animais 23 e sua dieta pode variar de acordo com as espécies, habitat, disponibilidade de presas e condições ambientais, como temperatura e níveis de água 24 . As espécies M. niger e C. crocodilus se alimentam principalmente de insetos (coleópteros), aranhas, caranguejos, moluscos e vertebrados como peixes, aves, répteis e mamíferos 9,11,23,25 .
Aproximadamente 82% dos itens alimentares registrados na dieta de M. niger e C. crocodilos neste estudo, são os mesmos registrados para estas espécies na Amazônia 9,11,23,26 e nos Llanos Venezuelanos 26,27 . A alta incidência de peixes na dieta das espécies está de acordo com informações anteriores 23,26 , e pode estar relacionado ao fato de que os animais analisados são machos, considerando que estes utilizam com maior frequência o habitat aquático, quando comparado às fêmeas, que no período reprodutivo passam por longos períodos de incubação dos ovos em terra firme 28 . Estudos de Da Silveira e Magnusson 23 , no arquipélago de Anavilhanas, Amazonas, apontam para uma maior proporção de peixes consumidos por C. crocodilus em lagos da região, sendo tal resultado provavelmente relacionado à maior disponibilidade de peixes, menor profundidade e correnteza neste ambiente 23 , que aumenta a vulnerabilidade das presas aos crocodilianos, quando comparado a ambientes lóticos, que apresentam maior profundidade e correnteza.
A espécie C. crocodilus ocupa poças com vegetação flutuante e herbáceas aquáticas marginais, sendo estes habitats permanentes e não dependentes diretamente do pulso de inundação 29 . Estudos de Da Silveira & Magnusson 23 apontam a ingestão de material vegetal pelas espécies estudadas, sendo esta considerada como acidental pelos autores, todavia, no presente estudo o item Brachiaria sp. foi classificado como acessório na dieta de C. crocodilus. Considerando que a proteína vegetal não é digerida ou assimilada por crocodilianos 30 , a elevada importância de material vegetal na dieta das espécies poderia estar associada ao microhabitat utilizado por espécies de peixes. Macrófitas aquáticas são utilizadas por insetos, aves e peixes como berçário, refúgio e sítio de forrageamento 31 . A migração entre habitat de macrófitas por peixes dulcícolas têm sido estudada, sendo visto que a dinâmica de movimentação entre macrófitas e águas abertas por Characiformes, e outras ordens de peixes, é relacionada a tácticas anti-predação (refúgio) e forregeamento 31 . Dessa forma, é sugerido com o estudo que a presença de material vegetal no estômago de ambas as espécies, esta mais associado a captura de peixes e outros organismos, que utilizam tal microhabitat, do que o consumo deste item propriamente dito.
Segundo Santos et al 22 , em estudos no Pantanal brasileiro, C. crocodilus consumiu principalmente animais aquáticos, abundantes na fauna terrestre (mamíferos e aves). No entanto, em um estudo em Caño Negro, Costa Rica, a espécie C. crocodilusfuscus ingeriu frequentemente aves aquáticas 32 . Mamíferos são encontrados com frequência na dieta de C. crocodilus27,10 , dado não corroborado neste estudo. O consumo de organismos terrestres pode estar associado a variação na disponibilidade de peixe no ambiente ao longo do ano, em decorrência da flutuação hidrológica no ambiente estudado 25 .
As proteínas animais contêm mais aminoácidos essenciais do que as proteínas vegetais. As proteínas de alto valor nutritivo são encontradas na carne, peixes e aves 33 . Entretanto, os peixes são a grande fonte de ácidos graxos, devido à sua alimentação fitoplanctônica e/ou zooplanctônica 34 . Crocodilianos em habitat natural, que têm sua dieta composta por peixes, moluscos, crustáceos, e espécies silvestres, possuem normalmente valores maiores de ácidos graxos poliinsaturados do que saturados 9 .
Pesquisas preliminares sugeriram que M. niger pode afetar ecologicamente C. crocodilus35 . Todavia, apesar de ambas as espécies utilizarem itens alimentares similares em suas dietas, a pesquisa não pode indicar a existência de competição trófica, considerando que é necessário avaliar a complexidade estrutural, presença de microhabitats do Lago Cuniã e disponibilidade de presas para as espécies analisadas. Destacamos o maior consumo de peixes pelas espécies de jacarés estudadas, dessa forma, medidas de manejo e conservação da ictiofauna regional são importantes a fim de manter a sobrevivência e prevalência de M. niger e C. crocodilus e promover outras fontes de renda para as comunidades residentes na Resex Cuniã.















