Introducción
El síndrome cardiorrenal (SCR) se caracteriza por una clínica variable, una fisiopatología compleja no dilucidada por completo, con una alta carga de morbimortalidad1-3. Existe un alto número de hospitalizaciones por SCR en Estados Unidos y en Europa, las cuales corresponden al 90 % del millón de hospitalizaciones anuales por falla cardiaca descompensada, la mayoría de ellas por manifestaciones derivadas de la sobrecarga de líquidos1,2.
La terapia estándar para el manejo de la falla cardiaca descompensada consiste en diuréticos de asa y vasodilatadores1,4. El perfil de seguridad, eficacia y limitaciones derivadas, especialmente de los efectos adversos y la resistencia a los diuréticos que pueden presentar algunos pacientes, genera cierta preocupación y son motivo de investigación1,4.
El objetivo de esta revisión es hacer un repaso de los mecanismos fisiopatológicos implicados en los síndromes cardiorrenales, las opciones terapéuticas farmacológicas, las herramientas disponibles para delimitar la resistencia a los diuréticos y el papel de las terapias de ultrafiltración.
Definición
El SCR es conocido como un espectro de los trastornos que involucran tanto el corazón como los riñones, en los que la disfunción aguda o crónica en un órgano puede inducir una disfunción aguda o crónica en el otro órgano1,5-9.
El primer intento de definir formalmente el SCR provino del grupo de trabajo del National Heart, Lung, and Blood Institute de Estados Unidos en 2004, y fue conceptualizado formalmente como el resultado de interacciones entre los riñones y otros compartimentos circulatorios que aumentan el volumen circulante que exacerba los síntomas de insuficiencia cardiaca y la progresión de la enfermedad1,10,11.
Clasificación
La Acute Dialysis Quality Initiative describió un enfoque consensuado en 2008 al reconocer un espectro clínico más amplio que puede representar una desregulación cardiorrenal, según dos fenotipos principales: síndromes cardiorrenales y renocardiacos, basados en el compromiso primario del proceso de la enfermedad, los cuales fueron agrupados posteriormente en cinco subtipos: tabla 1 1,2,11,12.
Tabla 1 Clasificación del SCR basado en el consenso Acute Dialysis Quality Initiative

Fuente: adaptado con base en Rangaswami J, Bhalla V, Blair J, Chang T, Costa S, Lentine K, et al., 20191.
Fisiopatología
La explicación convencional para el desarrollo del SCR en el contexto de trastorno cardiaco primario se basa en la incapacidad del corazón como bomba, para producir un adecuado flujo anterógrado que se traduce en hipoperfusión renal, lo cual conlleva a la activación del eje renina-angiotensina-aldosterona (RAA) del sistema nervioso simpático (SNS) y de la secreción de vasopresina, dando como resultado un aumento de la reabsorción tubular proximal de sodio y agua para mantener volúmenes plasmáticos efectivos, lo que eventualmente resulta en oliguria, mayor congestión, aumento de la precarga y empeoramiento de falla de bomba, tanto en falla cardiaca con fracción de eyección del ventrículo izquierdo (Fevi) como disminuida o preservada1,13,14.
A través del registro Adhere (Registro Nacional de Insuficiencia Cardiaca Descompensada Aguda) se demostró que la incidencia de aumento de la creatinina sérica fue similar entre los pacientes con insuficiencia cardiaca aguda, con función sistólica reducida y preservada1,15.
Los riñones tienen un circuito arterial de baja resistencia y reciben el 25 % del gasto cardiaco, requiriendo un adecuado flujo sanguíneo renal venoso y arterial para mantener el filtrado glomerular1. En este contexto, las presiones venosas centrales elevadas resultan en hipertensión venosa renal, aumento de la resistencia renal y, en última instancia, disminución del flujo sanguíneo renal10,16.
Varias vías adicionales están involucradas en la lesión cardiaca o renal para el desarrollo del SCR, estas implican activación del SNS, inflamación crónica, desequilibrio en la proporción de especies reactivas de oxígeno/producción de óxido nítrico y activación persistente del eje renina angiotensina aldosterona1,5. La producción de citoquinas activas del SNS genera un aumento de las concentraciones séricas de noradrenalina, además se provoca la liberación de especies reactivas de oxígeno de los leucocitos y crea un ciclo vicioso por medio de los distintos mecanismos5.
Se han evidenciado, principalmente implicadas como sustancias proinflamatorias en lesión renal aguda en modelos experimentales, varias moléculas inflamatorias como TNF-α (factor de necrosis tumoral-α), IL-1 (interleucina-1) e IL-6 (interleucina-6), con efectos deletéreos directos también a nivel cardiaco1,17.
Como resultado de la inflamación y el estrés oxidativo se genera fibrosis, un marcador de irreversibilidad, y se cronifica la insuficiencia cardiaca y la lesión renal a enfermedad renal crónica, lo que ha llevado a algunos autores a etiquetarla como un mecanismo clave en la fisiopatología del SCR5,18. De igual manera, en la cardiomiopatía urémica (SCR tipo 4) hay hipertrofia del ventrículo izquierdo, lo que resulta en reducción en la densidad capilar e isquemia microvascular, las cuales se asocian con la progresión de la cardiopatía urémica1,5. Dichos mecanismos tienen una relación interdependiente entre la respuesta cardiaca y la renal5.
Manejo farmacológico de la congestión en presencia de SCR
Terapias descongestivas
Los objetivos del tratamiento farmacológico del SCR consisten en lograr una mejoría de los signos de congestión vascular y asegurar presiones adecuadas para garantizar la perfusión tisular19-21. Los diuréticos son la piedra angular del manejo descongestivo, se prescriben en aproximadamente el 90 % de los pacientes con insuficiencia cardiaca descompensada con sobrecarga hídrica, por sus efectos en la disminución de la presión venosa central resultado de las pérdidas urinarias de sodio y agua1,5.
Los diuréticos de asa inhiben el cotransportador de Na + K + 2Cl− en la rama ascendente gruesa del asa de Henle1. Se prefieren respecto a los demás diuréticos debido a su menor incidencia de hipocalemia, hiponatremia y empeoramiento de la función renal5. No obstante, aunque su uso parece ser seguro y efectivo en la insuficiencia cardiaca descompensada, no se conoce con certeza si eleva los niveles de creatinina en individuos con una función renal basal más grave, por ejemplo, enfermedad renal crónica 4 o 51.
Al respecto, el estudio DOSE (protocolo prospectivo, doble ciego y aleatorizado) evaluó las estrategias diuréticas con furosemida endovenosa administrada en bolo, dos veces al día o en infusión continua y comparando dosis bajas (dosis IV numéricamente equivalente a la dosis oral del paciente) y dosis altas (dosis IV, 2,5 veces equivalente a la dosis oral)22. En sus resultados no hubo diferencia significativa en la evaluación global de los síntomas o cambio en la creatinina sérica durante 72 h con administración diurética en bolo o infusión continua, o con una dosis baja versus una dosis alta; sin embargo, los pacientes asignados a la estrategia de dosis más altas experimentaron un incremento de creatinina transitoria22.
El tratamiento con diuréticos, a diferencia de muchas otras terapias farmacológicas para la insuficiencia cardiaca, sigue siendo en gran medida empírico1,19. Las mejores prácticas clínicas basadas en la evidencia para el uso de diuréticos siguen siendo inciertas, ya que si bien proporcionan un rápido alivio de los síntomas, no han demostrado beneficio en desenlaces de mortalidad o de rehospitalización1,19.
Resistencia a los diuréticos
Es ampliamente conocido que el uso recurrente de diuréticos en el SCR puede conllevar a la disminución de su eficacia, lo que se conoce como resistencia a los diuréticos1. Esto puede precipitarse con el uso de dosis sucesivas por medio de dos mecanismos: a corto plazo se genera el fenómeno de frenado cuando los diuréticos reducen el volumen de líquido extracelular, de manera que se activa el SNS y la producción de angiotensina II, lo que estimula la reabsorción de sodio tubular proximal y a largo plazo se relaciona con hipertrofia del túbulo contorneado distal (zona del cotransportador sodio/cloro sensible a tiazidas) y del túbulo colector, lo que conlleva al incremento de la reabsorción de sodio mediada por dichos segmentos de la nefrona1,19.
Si bien conocemos el término de resistencia al diurético, no está bien establecida una definición global, ni mucho menos una estrategia para diagnosticarla de manera certera. No obstante, la importancia clínica de la resistencia a los diuréticos se ve reforzada por investigaciones recientes, en las cuales se ha destacado la respuesta diurética como un fuerte predictor pronóstico al constituir un factor independiente de mayor mortalidad y rehospitalización por insuficiencia cardiaca, por lo cual se han propuesto varias alternativas para el manejo de la resistencia a los diuréticos23. A continuación, mencionaremos algunas alternativas de manejo:
1. Optimización de la farmacocinética de la terapia con diuréticos de asa al pasar de la administración oral a la intravenosa para evitar la absorción variable que ocurre en estados congestivos23.
2. Bloqueo tubular: añadir diuréticos tiazídicos por su efecto diurético a nivel distal24. Las tiazidas siguen siendo el diurético de elección para combinar (bloquean entre 5 y 10 % de la reabsorción de sodio filtrado en comparación al 25 % de diuréticos de asa), contrarrestando la hipertrofia tubular distal compensatoria15,23,24. Los antagonistas de los receptores de mineralocorticoides en dosis bajas, administrados a pacientes con insuficiencia cardiaca con FEVI disminuida, se asocian con una menor mortalidad, por lo que se encuentran incluidos en guías de manejo15 y sus efectos en falla cardiaca descompensada son inciertos.
En un ensayo de 100 pacientes hospitalizados por insuficiencia cardiaca descompensada, la adición de espironolactona, independientemente de la respuesta a los diuréticos de asa, se asoció con una resolución más rápida de los síntomas y una mejor función renal15,23. Un estudio más pequeño sugirió que los beneficios del antagonista del receptor de mineralocorticoides se mantienen incluso en pacientes con resistencia al diurético de asa23.
Aunque los inhibidores de la anhidrasa carbónica, como la acetazolamida y otros diuréticos como los vaptanes (tolvaptán), pueden aumentar la diuresis en pacientes con SCR, la evidencia es escasa y no concluyente en cuanto a los desenlaces a nivel renal o cardiaco en pacientes con insuficiencia cardiaca descompensada25-29. Existe una necesidad imperiosa de encontrar nuevas intervenciones que mejoren las alternativas disponibles de manera segura y que mejoren el éxito de la descongestión en la insuficiencia cardiaca descompensada con sobrecarga hídrica. En curso se encuentra el estudio Advor, a completarse en el año 2022, el cual compara el efecto descongestivo de diurético de asa más el placebo vs. diurético de asa más acetazolamida29.
Los inhibidores del cotransportador de sodio-glucosa 2 (SGLT2) tienen beneficios más allá de la reducción de la glucosa, por mecanismos que aún no están bien establecidos30-32. En el 2019 con el estudio DAPA-HF y recientemente con Emperor-Reduced se supone una nueva era en el tratamiento de la insuficiencia cardiaca con fracción de eyección reducida sin diabetes mellitus, estos estudios han mostrado una reducción del riesgo combinado de muerte de origen cardiovascular u hospitalización por descompensación de insuficiencia cardiaca33,34; sin embargo, el beneficio de estos medicamentos se limita a pacientes con insuficiencia cardiaca más avanzada pero estable, sin conocer realmente su desempeño en el paciente con sobrecarga hídrica y SCR32,35. Sin duda alguna, en el futuro cercano tendremos nuevos estudios que nos mostrarán su efecto en pacientes con estas características.
3. En tercer lugar, se propone la administración concomitante de solución salina hipertónica (SSH) como una terapia complementaria para los diuréticos de asa intravenosa, para mejorar o restaurar la eficacia farmacológica inicial2,23. Entre los mecanismos propuestos para explicar sus beneficios, se ha considerado que evitaría el agotamiento intravascular y, por lo tanto, mantendría el flujo sanguíneo renal y la tasa de filtración glomerular durante el tratamiento con furosemida intravenosa2. El estudio SMAC-HF se realizó en pacientes con insuficiencia cardiaca y resistencia diurética que fueron asignados al azar a SSH (150 ml) más furosemida IV de dosis alta dos veces al día (250 mg) y una restricción moderada de sodio (120 mmol), en comparación con el mismo régimen diurético sin SSH y una dieta baja en sodio (80 mmol) (36). Aquellos que recibieron SSH mostraron un aumento significativo en la diuresis y una menor estancia hospitalaria, con un efecto favorable sobre el aclaramiento de creatinina; durante el seguimiento, el grupo de SSH y restricción moderada de sodio tuvo menores tasas de reingreso y mortalidad36.
En comparación con la administración de altas dosis de furosemida intravenosa sola, el uso concomitante de SSH ha demostrado una resolución clínica más rápida y completa de la congestión, ya que mejora el flujo renal al provocar expansión del volumen circulante eficaz con aumento de la presión hidrostática a nivel glomerular y peritubular, incrementándose la natriuresis y la concentración diurética, un potencial para proteger contra el deterioro de la función renal2,15.
A continuación, exponemos un algoritmo para el abordaje de la resistencia al diurético (figuras 1 y 2).

Fuente: elaboración con base en JACC, 75(10), 2020.
Figura 1 Abordaje propuesto para el paciente con sobrecarga hídrica

Fuente: elaboración con base en Costanzo M, Ronco C, Abraham W, Agostoni P, Barasch J, Fonarow G, et al., 20174.
Figura 2 Manejo de la resistencia al diurético
Se han propuesto varios predictores para la resistencia a los diuréticos. Una de las más estudiadas es la presencia de congestión venosa renal y la alta resistencia de la arteria renal, riesgo que se vuelve aún mayor cuando ambos factores están presentes conduciendo a la resistencia diurética37.
Una estrategia para evaluar dichos parámetros es la ecografía Doppler de la hemodinámica arterial y venosa, que es una técnica no invasiva, de bajo costo y fácilmente disponible para la evaluación de los riñones y que permite valorar la anatomía, la perfusión y las presiones estimadas38. Se ha considerado que el principal determinante en la respuesta a los diuréticos en un paciente con insuficiencia cardiaca es la interrelación entre los parámetros hemodinámicos relacionados con el flujo sanguíneo renal, por lo que la ecografía Doppler se podría considerar un método confiable para la estratificación pronóstica de los pacientes con SCR37. Dentro de las mediciones potenciales de la Doppler renal, el índice de resistencia renal (IRR) es una medida del flujo sanguíneo renal que refleja las anomalías renales vasculares y parenquimatosas, por lo que representa una herramienta útil para detectar anomalías en la perfusión renal, que a su vez se asociaría a la progresión de la insuficiencia cardiaca37,39. Es calculada por el análisis espectral de la forma de onda Doppler arterial usando la fórmula de Pourcelot, es decir, la velocidad sistólica máxima menos la velocidad diastólica final, dividida por la velocidad sistólica máxima38.
En adultos sanos, los valores normales de IRR son de alrededor de 0,60, con una diferencia entre los dos riñones de menos del 5-8 %; un IRR de 0,70 o superior se considera anormal y generalmente predice un resultado desfavorable38. Ciccone, et al. en la universidad de Bari, en Italia, valoraron el IRR en pacientes con insuficiencia cardiaca que reciben diuréticos de asa, evidenciando que un IRR ≥ 0,71 se asoció tanto a una dosis diurética basal significativamente más alta, lo que sugiere que desarrollarían resistencia diurética39-41.
En condiciones normales, una disminución en el gasto cardiaco hará que el sistema autorregulador reduzca las resistencias renales para mantener el flujo renal dentro del rango normal; sin embargo, cuando hay alteración de estos sistemas reguladores por mecanismos neurohormonales, como sucede en la insuficiencia cardiaca, podría conllevar al aumento de las resistencias intrarrenales, lo que resultará en una filtración glomerular deteriorada38,39.
Es importante tener en cuenta que existen otros factores que pueden alterar las resistencias renales como el aumento de la rigidez arterial, la aterosclerosis arterial, las lesiones parenquimatosas y la congestión venosa renal37,38. La congestión venosa renal puede conllevar al incremento de la resistencia de la arteria renal, sin embargo, también se ha considerado como un factor independiente del IRR, dado que incrementa la presión intersticial renal y la presión capilar glomerular, deteriorando la función de filtración37.
El alto IRR y la congestión venosa renal, en el contexto de insuficiencia cardiaca, se han asociado independientemente con empeoramiento de la función renal y con el uso de altas dosis de diuréticos de asa, sobretodo si ambos factores están presentes, por lo que podrían predecir una respuesta diurética deficiente37-39. Una de las mayores desventajas para esta medida como predictor de resistencia al diurético es que al tratarse de una medición ecográfica, su validez será operador dependiente42.
Se han propuesto otras medidas para prever la efectividad de la terapia descongestiva, según la resistencia al diurético como dispositivos de monitorización de presión venosa central, presión pulmonar, aun sin uso de manera generalizada en esta población43.
Para intentar definir si la terapia al diurético es eficiente, se debe tener en cuenta la dosis del diurético utilizado, el gasto urinario, el cambio en el peso corporal y la excreción de sodio44. Algunos autores la definen como la atenuación del máximo efecto diurético que limita la excreción de sodio y de cloro; la resistencia a lo diurético se asocia con un empeoramiento en la función renal y un mayor riesgo de hospitalización por falla cardiaca y mortalidad1.
Terapias de reemplazo renal
La ultrafiltración consiste en la extracción de agua plasmática a través de fibras huecas de una membrana semipermeable o hemofiltro, en respuesta a un gradiente de presión transmembrana. Se han desarrollado dispositivos simplificados que permiten manejar bajos flujos sanguíneos dentro de un sistema extracorpóreo con capacidad inferior a 50 mL, con tasas de ultrafiltración entre 0 y 500 mL con accesos venosos centrales o periféricos, los cuales garanticen un flujo de sangre requerido, en muchos casos sin necesidad de trasladar al paciente a una unidad de cuidados intensivos42,45.
La ultrafiltración temprana puede ser una alternativa a los diuréticos intravenosos en pacientes con insuficiencia cardiaca descompensada con datos de sobrecarga hídrica, con beneficios potenciales que incluyen menor pérdida de potasio, menor liberación de renina y aldosterona y mayor pérdida de sodio1,46.
Unload fue un estudio prospectivo, aleatorizado y multicéntrico que comparó la ultrafiltración frente al tratamiento convencional con diuréticos endovenosos, encontrándose que la ultrafiltración produce de manera segura una mayor pérdida de peso y líquidos que los diuréticos intravenosos, con una reducción significativa en las tasas de rehospitalización a los 90 días; sin embargo, no queda claro si los resultados obtenidos podrían haberse logrado en el brazo diurético con una dosis más agresiva43.
En un intento de valorar la eficacia y la seguridad de la ultrafiltración en pacientes con insuficiencia cardiaca descompensada, complicada por la congestión persistente y el deterioro de la función renal, se realizó el estudio Carress-HF, en el que se comparó una estrategia escalonada de terapia farmacológica con la ultrafiltración, evidenciándose que el tratamiento médico intensivo fue superior a la ultrafiltración para la preservación de la función renal a las 96 horas, con una pérdida de peso similar con los dos enfoques, teniendo en cuenta que la ultrafiltración se asoció con una tasa mayor de eventos adversos47.
El estudio Avoid-HF, diseñado como un estudio aleatorizado y multicéntrico, comparó la ultrafiltración y el tratamiento médico en la insuficiencia cardiaca descompensada, con regímenes de tratamiento ajustables en lugar de fijos, en ambos brazos. El grupo de ultrafiltración tuvo una discreta tendencia, no significativa, a mayores días libres hasta el primer evento de descompensación de la falla cardiaca, con menos eventos cardiovasculares. Además, se evidenció que en el grupo de ultrafiltración se experimentaron mayores eventos adversos como sangrado, infección y trombosis venosa asociados al catéter42.
La utilidad de la ultrafiltración es latente para pacientes con alta resistencia diurética y reingresos frecuentes por insuficiencia cardiaca descompensada, como una terapia para manejo de síntomas o de paliación para disminuir hospitalizaciones. En la actualidad, las guías recomiendan la UF para ese grupo selecto de pacientes. Resta además estandarizar los parámetros para programar la tasa de ultrafiltración ajustándose a las variables hemodinámicas y a la función renal de cada paciente, como lo hizo el estudio Unload4.
Diálisis peritoneal en falla cardiaca refractaria
La diálisis peritoneal (DP) como técnica de UF fue descrita en 1949 por Schneierson y en los últimos años se ha utilizado como opción de tratamiento para pacientes con falla cardiaca refractaria; en comparación con la hemodiálisis, ofrece algunas ventajas como lo son una mayor preservación de la función renal residual y continuidad en la ultrafiltración con menos compromiso de la estabilidad hemodinámica48,49. Además, se han demostrado otros beneficios como depuración de moléculas proinflamatorias como la interleuquina 1 (IL-1) y factor de necrosis tumoral (TNF) que afectan la contractilidad miocárdica y se asocian con progresión de la falla cardiaca; también en aquellos pacientes con ascitis se reduce la presión intraabdominal, aliviando los síntomas derivados y mejorando la calidad de vida de los pacientes49,50.
Estudios realizados han demostrado la efectividad de la DP para ultrafiltración y para la mejoría de los síntomas congestivos, disminución de tasa y duración de hospitalizaciones por descompensación de falla cardiaca, sin que se evidencie deterioro en la función renal48,51. Debido a que las cohortes en los distintos estudios incluyen pocos pacientes, con muestras heterogéneas y gran carga de morbilidades, no se ha logrado establecer un beneficio con respecto a la sobrevida a los 12 meses, en comparación al tratamiento médico48,49.
Las modalidades que se han empleado son: diálisis peritoneal intermitente, diálisis peritoneal continua ambulatoria (CAPD) y la diálisis peritoneal automatizada (APD)48,49.
Desde el punto de vista económico, en algunos trabajos se ha determinado una reducción de cuatro veces en costos anuales derivados de la atención hospitalaria en comparación con la terapia estándar48,49,51. Se resumen las ventajas y las desventajas para cada una de las alternativas de manejo en la figura 3.
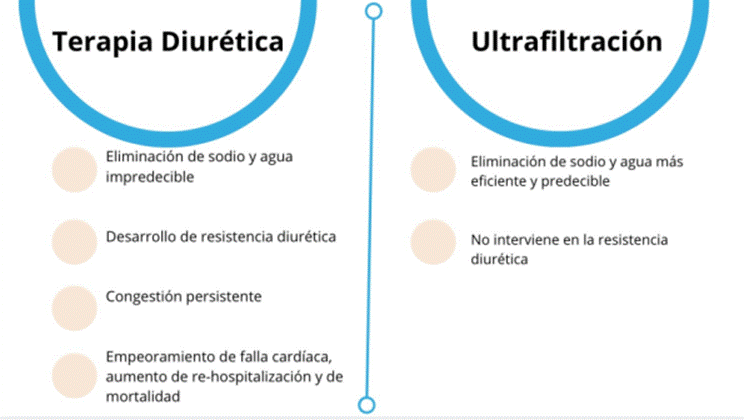
Fuente: elaboración con base en Costanzo, et al.4
Figura 3 Ventajas y desventajas para las dos estrategias
Conclusión
El SCR en sus diferentes presentaciones hace parte de una gran variedad de relaciones interdependientes entre el sistema cardiaco y el renal. La presencia de signos de congestión constituye uno de sus grandes desafíos, motivo por el cual se dan la mayoría de las hospitalizaciones en el caso de la insuficiencia cardiaca.
Como se ha descrito, a la luz de la terapéutica actual, la piedra angular del manejo son los diuréticos de asa, sin embargo, a medida que progresa la insuficiencia cardiaca y se utilizan de manera repetitiva los diuréticos, hay una respuesta inadecuada a estos. Los enfoques adicionales, como la optimización de las dosis del diurético de asa, el bloqueo tubular con agentes diuréticos tiazídicos o antagonistas de la aldosterona en dosis altas y el uso de SSH, son alternativas para contrarrestar la resistencia al diurético. Hay otras alternativas como los inhibidores de anhidrasa carbónica e iSGLT2 que pudieran ser opciones seguras que mejoren el éxito de la descongestión, sin embargo, aún no cuentan con estudios que soporten su uso en los pacientes con SCR.
La ultrafiltración y la DP son alternativas terapéuticas con potenciales ventajas dadas por la eliminación predecible del sodio corporal. Es necesario continuar el estudio para delimitar y dar manejo a la sobrecarga hídrica, la cual es la principal queja de los pacientes con insuficiencia cardiaca, además de la rehospitalización y la morbimortalidad de nuestros pacientes.















